通常人们把拆开1 mol某化学键吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估计化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下列是一些化学键的键能。
| 化学键 |
C—H |
C—F |
H—F |
F—F |
键能/(kJ·mol ) ) |
414 |
489 |
565 |
155 |
根据键能数据估算下列反应的反应热ΔH为:CH4 (g)+4F2 (g) ===CF4(g)+4HF(g)
A.–1940 kJ · mol-1 B.1940 kJ · mol-1
C.–485 kJ · mol-1 D.485 kJ · mol-1
下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是
| A.胆矾、漂白粉、氯化钾、氯气 |
| B.冰醋酸、福尔马林、硫酸钠、乙醇 |
| C.单甘油酯、混甘油酯、苛性钾、石灰石 |
| D.盐酸、水煤气、醋酸、干冰 |
将一定质量的镁和铝的混合物投入100ml盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。若不考虑金属和盐酸反应时HCl的挥发,则下列说法正确的是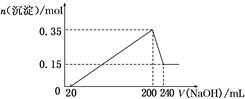
| A.镁和铝的总质量为9 g |
| B.盐酸的物质的量浓度为5 mol·L-1 |
| C.NaOH溶液的物质的量浓度为6 mol·L-1 |
| D.生成的氢气在标准状况下的体积为11.2 L |
32g铜跟适量的浓硝酸反应,铜全部作用后,共收集到NO、NO2混合气体22.4L(标准状况下),则反应消耗的硝酸的物质的量是
| A.1.0 mol | B.1.5 mol | C.2.0 mol | D.2.5 mol |
已知反应方程式:NH4NO3+Zn=ZnO+N2↑+2H2O,下列有关说法中正确的是
| A.该反应中NH4NO3只作氧化剂 | B.ZnO是还原产物 |
| C.氧化产物只有N2 | D.该反应每生成1mol N2转移5mol电子 |
取四份碘水于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是
| A.Ⅰ中溶液分层,下层呈紫红色 |
| B.Ⅱ中溶液分层,下层呈紫红色 |
| C.Ⅲ中溶液分层,下层呈棕黄色 |
| D.Ⅳ中溶液不分层,溶液呈无色 |