(11分)实验室用密度为1.84g/mL质量分数为98%的浓H2SO4来配制100mL 3.0 mol·L-1稀H2SO4溶液,请回答下列问题:
(1)计算所需浓H2SO4体积为___________。
(2)量取所需浓H2SO4,应选用_____________量筒(选填5mL、10mL、20mL)。
(3)稀释浓H2SO4的方法(简要操作)____________________________________________。
(4)配制所需仪器,除量筒和胶头滴管外,还必须用到的玻璃仪器有
(5)定容时的正确操作方法是:______________________________。
(6)下列操作结果使溶液物质的量浓度偏高的是( )
A没有将洗涤液转入容量瓶中 B.容量瓶用蒸馏水洗涤后,未干燥
C定容时,俯视容量瓶的刻度线 D.加水定容时,加水超过了刻度线
E. 浓H2SO4稀释后立即转移至容量瓶中并定容
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
下列有关叙述正确的是( )
| A.贝诺酯分子中有三种含氧官能团 |
| B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚 |
| C.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应 |
| D.贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠 |
0.1 mol某有机物的蒸气跟过量O2混合后点燃,生成13.2 g CO2和5.4 g H2O,该有机物跟金属钠反应放出H2;又能跟新制Cu(OH)2悬浊液加热时生成砖红色沉淀,此有机物还能跟乙酸反应生成酯类化合物。该酯类化合物的结构简式可能是( )
| A.CH3CH(OCH3)CHO |
| B.OHCCH2COOCH2CH3 |
| C.CH3COOCH(CH3)CHO |
| D.CH3COOCH2CH2COCH3 |
将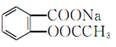 完全转变为
完全转变为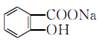 的方法为( )
的方法为( )
| A.与足量的NaOH溶液共热后,再通入CO2 |
| B.溶液加热,通入足量的HCl |
| C.与稀H2SO4共热后,加入足量的Na2CO3 |
| D.与稀H2SO4共热后,加入足量的NaOH |
0.1 mol阿司匹林其学名为乙酰水杨酸,结构简式为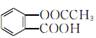 与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
| A.0.1 mol | B.0.2 mol |
| C.0.3 mol | D.0.4 mol |
某中性有机物,在酸性条件下可以发生水解,生成相对分子质量相同的A和B,A是中性物质,B可以与碳酸钠反应放出气体,此有机物是( )
| A.CH3COOC3H7 | B.CH3COOC2H5 |
| C.CH3COONa | D.CH3CH2Br |