(10分)(1)已知在101 kPa时,CO的燃烧热为283 kJ·mol-1。相同条件下,若2 mol CH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,甲烷的燃烧热是多少?
(2)现有CO和CH4组成的混合气体共0.75 mol,完全燃烧生成二氧化碳气体和18 g液态水,求放出热量有多少?
已知某饱和氯化钠溶液体积为VmL,溶液密度为d g·cm-3,溶质的质量分数为ω%,物质的量浓度为c mol·L-1,溶液中含NaCl的质量为m g。
(1)用ω表示该温度下NaCl的溶解度是。
(2)用m、V表示溶液的物质的量浓度是。
(3)用ω、d表示溶液的物质的量浓度是。
(4)用c、d表示溶液中溶质的质量分数是。
将25.0g胆矾(CuSO4·5H2O)溶于水配成200mL溶液,其密度为1.25g/cm3,试计算
(1)该溶液中CuSO4的质量分数为,SO42-的物质的量浓度为
(2)从该溶液中取出20mL加水稀释到100mL,稀释后的溶液中CuSO4的物质的量浓度为
(3)向稀释后的溶液中加入100mL1mol/L的NaOH溶液可生成沉淀的质量为此时溶液中的溶质是(填化学式)
(9分)将含有C、H、O的芳香族化合物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
⑴燃烧此化合物3.24g,须消耗氧气的质量是多少?
⑵求此化合物的分子式?⑶该化合物1H核磁共振谱上有5个信号峰,试写出符合的结构简式。
工业上铝土矿(含氧化铝、氧化铁等)制取铝的流程如下:
经分析,生产原料(铝土矿)经提取Al2O3后的残渣(赤泥)的部分成分见右表(以氧化物表示,Na2O由NaOH折算),且已知铝土矿中的Fe2O3全部转入赤泥。
| Al2O3 |
Fe2O3 |
Na2O |
|
| 铝土矿 |
55% |
16% |
0% |
| 赤泥 |
15% |
48% |
8% |
(1)生产中每消耗1 t铝土矿将产生吨赤泥。
(2)试计算每炼出1 t铝,理论上需要多少吨铝土矿?应补充多少吨NaOH?
已知Fe2O3在高炉中有下列反应:Fe2O3+CO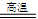 2FeO+CO2反应形成的固体混合物(Fe2O3·FeO)中,元素铁和氧的质量比用m(Fe)﹕m(O)表示。
2FeO+CO2反应形成的固体混合物(Fe2O3·FeO)中,元素铁和氧的质量比用m(Fe)﹕m(O)表示。
(1)上述固体混合物中,m(Fe)﹕m(O)不可能是。
A.21﹕9 B.21﹕7.5 C.21﹕6
(2)若m(Fe)﹕m(O)=21﹕8,计算Fe2O3被CO还原的百分率。