常温下用惰性电极电解200 mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图中Ⅰ、Ⅱ所示(以下气体体积已换算成标准状况下的体积),根据图中信息回答下列问题。
(1)通过计算推测:原混合溶液中NaCl和CuSO4的物质的量浓度。
c(NaCl)=________mol·L-1, c(CuSO4)=________mol·L-1。
(2)若用惰性电极电解NaCl和CuSO4的混合溶液200 mL,经过一段时间后两极均得到224 mL气体,则原混合溶液中氯离子浓度的取值范围为_______,铜离子浓度的取值范围为________。
能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l); H=-570 kJ·mol-1;
H=-570 kJ·mol-1;
② H2(g)+1/2O2(g)=H2O(g) ; H="-242" kJ·mol-1
H="-242" kJ·mol-1
③ C(s)+1/2O2(g)="CO(g)" ; H= —110.5 kJ·mol-1
H= —110.5 kJ·mol-1
④C(s)+O2(g)=CO2(g); H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1
⑤ CO2(g) +2H2O(g)=2CH4(g) +2 O2(g); H= +890 kJ·mol-1
H= +890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的是
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)= H2(g)+ CO (g) H="a" kJ·mol-1;则a=;该反应的熵
H="a" kJ·mol-1;则a=;该反应的熵 S0(选填“>”、“=”、“<”)。
S0(选填“>”、“=”、“<”)。
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx ,反应原理如下:
4xNH3 +6 NOx (2x + 3)N2 + 6xH2O
(2x + 3)N2 + 6xH2O
某化学兴趣小组模拟该处理过程的实验装置如下:
①装置A中发生反应的化学方程式为 ▲。
②装置C的作用是 ▲。
③装置F的作用是 ▲。
(2)工业上也常用Na2CO3溶液吸收法处理NOx 。
已知: NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2(I)
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2(II)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是 ▲(填字母)。
A.1.3 B.1.6 C.1.8
②将1mol NOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3ˉ、NO2ˉ两种离子的物质的量随x变化关系如图所示:
图中线段a表示 ▲离子随x值变化的关系;若用溶质质量分数为21.2%的 Na2CO3溶液吸收,则需要Na2CO3溶液至少 ▲g。
③用足量的Na2CO3溶液完全吸收NOx,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则NOx中的x值为 ▲。
(3)氨催化吸收法和Na2CO3溶液吸收法处理NOx尾气共同的优点是 ▲。
常见金属单质A、B和非金属单质C、D以及它们化合物之间的转化关系如下。F、J既能溶于强酸M又能溶于强碱N,Z的摩尔质量为198 g·mol-1,且其中各元素的质量比为:
钾 : 金属B : 氧=39 : 28 : 32。
请回答下列问题: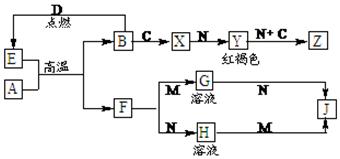
(1)Z的化学式为: ▲ 。
(2)写出检验X中阳离子的方法: ▲ 。
(3)写出E和A在高温下反应的化学方程式为: ▲ 。
(4)写出A和N反应的离子方程式: ▲ 。
⑴随着生活水平的提高,人们越来越关注营养平衡和自身的健康。
①粮食中的淀粉在人体中水解最终转化成▲,该物质在人体内被氧化,最终生成CO2和H2O,该过程对人体健康的意义是▲。
②食品添加剂亚硝酸钠的外观像食盐,并有咸味,但亚硝酸钠有很强的毒性。亚硝酸钠属于 ▲(选填“调味剂”、“防腐剂”或“着色剂”)。
③维生素C也称抗坏血酸。血液中运载氧的血红蛋白中含有Fe2+,人之所以患坏血病,是因为人体从摄取的食物中吸收的铁主要是Fe3+,Fe3+不能被人体吸收。维生素C的主要摄入途径是 ▲,维生素C在抗坏血病方面的作用原理是 ▲。
⑵中国是世界上最早研究和生产合金的国家之一。
①在原子反应堆中得以广泛应用的钠钾合金在常温下呈液态,说明合金的熔点比其成分金属的熔点 ▲。
②铜锌合金外观和金(Au)相似,常被误认为黄金。试写出一种鉴别黄铜与黄金的化学方法 ▲。铜器表面容易生成一层薄薄的铜绿[主要成份是Cu2(OH)2CO3],请写出铜在潮湿的空气发生电化学腐蚀时的负极反应式▲;用盐酸可以除去铜器表面的铜绿,该反应的化学方程式为 ▲。
③下列对金属制品采取的防护方法不正确的是 ▲(填序号)。
A.在电线的外面包上一层塑料层
B.在自行车钢圈上镀上一层金属铬
C.在海轮的铁制外壳上焊上铜块
⑶
①CO2是目前大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。请你写出有利于降低大气中CO2浓度的一项措施 ▲。
②水中含有的悬浮颗粒物等杂质,可以加入 ▲等混凝剂进行净化处理,利用其溶解后形成的 ▲具有吸附作用使水中的悬浮颗粒物沉降。
③最近,国内第一个跨区域日处理垃圾1000吨以上的垃圾焚烧发电厂在江苏如皋投入使用。下面列出了现代生活中的常见垃圾:
A.废纸 B.废电池 C.易拉罐 D.玻璃瓶 E.塑料制品
在焚烧处理前,除废电池外,还有 ▲(填序号)应剔除并回收,随意丢弃电池造成的主要危害是 ▲。
有5种烃:甲烷、乙炔、苯、环己烷、甲苯,分别取一定量的这些烃,完全燃烧后生成m mol CO2和n mol H2O。则
(1)当m=n时,该烃是,
(2)当m=2n时, 该烃是,
(3)当2m=n时, 该烃是,
(4)当4m=7n时,该烃是。