在学习中,我们经常应用类推法。下列左边正确,类推法应用于右边也正确的是
| A |
向FeCl2溶液中滴入氯水 2Fe2++ Cl2= 2Fe3++ 2Cl— |
向FeCl2溶液中滴入碘水 2Fe2++ I2= 2Fe3++2I— |
| B |
CO2通入漂白粉溶液中 CO2+ Ca2++2ClO—+H2O=CaCO3↓+ 2HClO |
SO2通入漂白粉溶液中 SO2 +Ca2++2ClO—+H2O=CaSO3↓+2HClO |
| C |
向Na2CO3溶液中滴入稀HNO3 CO32—+ 2H+ = CO2↑+ H2O |
向Na2SO3溶液中滴入稀HNO3 SO32— +2H+ = SO2↑+H2O |
| D |
向澄清石灰水中通入少量CO2气体 Ca2++2OH— +CO2= CaCO3↓+ H2O |
向澄清石灰水中通入少量SO2气体 Ca2++2OH— +SO2= CaSO3↓+H2O |
在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):N2(g)+3H2(g) 2NH3(g) ΔH<0,相关数据如下表所示:
2NH3(g) ΔH<0,相关数据如下表所示:
| 容器 |
甲 |
乙 |
丙 |
| 相关条件 |
恒温恒容 |
绝热恒容 |
恒温恒压 |
| 反应物投料 |
1mol N2、3mol H2 |
2mol NH3 |
2mol NH3 |
| 平衡时容器体积 |
V甲 |
V乙 |
V丙 |
| 反应的平衡常数K= |
K甲 |
K乙 |
K丙 |
| 平衡时NH3的浓度/mol·L-1 |
c甲 |
c乙 |
c丙 |
| 平衡时NH3的反应速率/mol·L-1·min-1 |
v甲 |
v乙 |
v丙 |
下列说法正确的是
A.V甲>V丙B.K乙>K丙C.c乙>c甲D.v甲=v丙
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.0.1mol·L-1 NaHCO3溶液中:c(H+)+2c(H2CO3)=2c(CO32-)+c(OH-) |
| B.0.1mol·L-1(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
| C.将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)>c(Cl-) |
| D.pH相等的①CH3COONa、②C6H5ONa、③Na2CO3、④NaOH四种溶液的物质的量浓度大小:①>②>③>④ |
下列依据相关实验或事实得出的结论正确的是
| A.SiO2既能与HF溶液反应,又能与NaOH溶液反应,说明SiO2是两性氧化物 |
| B.鸡蛋清溶液中加入饱和(NH4)2SO4溶液有白色沉淀产生,说明蛋白质发生了变性 |
| C.将少量某有机物滴加到新制氢氧化铜中,充分振荡,未见砖红色沉淀生成,说明该有机物不含醛基 |
| D.相同体积、pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强 |
镇咳药沐舒坦可由化合物甲和化合物乙在一定条件下反应制得: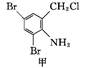 +
+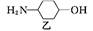

 +HCl
+HCl
下列有关叙述正确的是
| A.反应过程中加入适量K2CO3可提高沐舒坦的产率 |
| B.化合物甲的分子式为C7H4NBr2Cl |
| C.化合物乙既能与HCl溶液反应又能与NaOH溶液反应 |
| D.一定条件下,沐舒坦分别能发生消去、氧化、取代、加成反应 |
下列说法中正确的是
A.8NH3(g)+6NO2(g) 7N2(g)+12H2O(g) ΔH<0,则该反应一定能自发进行 7N2(g)+12H2O(g) ΔH<0,则该反应一定能自发进行 |
| B.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
| C.催化剂可以加快化学反应速率,也能增大化学反应的焓变 |
| D.NH3·H2O溶液加水稀释后,溶液中的值增大 |