将钠投入下列溶液中,反应的剧烈程度由强到弱的是
①水 ②NaOH溶液 ③0.1 mol·L-1盐酸 ④0.1 mol·L-1 FeCl3溶液
| A.④③②① | B.④③①② | C.③④①② | D.①③④② |
100 mL 6 mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速度,但又不影响生成氢气的总量,不可向反应物中加入适量的()
| A.碳酸钠(固体) | B.水 |
| C.硫酸钾溶液 | D.CH3COONa(固体) |
将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c(NH4+)=c(Cl-) ⑤c(NH4+)<c(Cl-)正确的是( )
| A.①⑤ | B.③④ | C.②⑤ | D.②④ |
已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH  CH3COO-+H+,要使溶液中
CH3COO-+H+,要使溶液中 值增大,可以采取的措施是()
值增大,可以采取的措施是()
| A.加少量烧碱溶液 | B.降低温度 | C.加少量冰醋酸 | D.加水 |
可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应①Br2 + 2e-= 2Br-
②2Br- - 2e-= Br2 ③Zn – 2e-= Zn2+ ④Zn2+ + 2e-= Zn其中表示充电时的阳极反应和放电时的负极反应的分别是()
| A.②和③ | B.②和① | C.③和① | D.④和① |
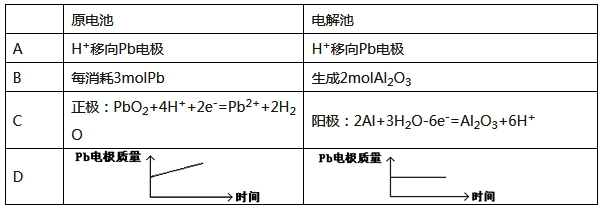
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以A1作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O Al2O3+3H2↑电解过程中,以下判断正确的是()
Al2O3+3H2↑电解过程中,以下判断正确的是()