下列的方法和结论正确的是
| A.向某溶液中滴加浓的NaOH溶液并加热,产生的气体能使湿润的红色石蕊试液变蓝,则原溶液中一定含有NH4+ |
| B.向某溶液中滴加盐酸酸化的氯化钡溶液,产生白色沉淀,则原溶液中一定有SO42- |
| C.向某溶液中滴加稀盐酸产生无色无味气体,产生的气体使澄清石灰水变浑浊,则原溶液中一定有CO32- |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,原溶液一定有Ca2+ |
已知充分燃烧a g乙炔气体时生成1 mol二氧化碳气体和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是()
| A.2C2H2(g)+5O2 (g)===4CO2 (g)+2H2O (l);ΔH=-4b kJ/mol |
B.C2H2(g)+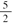 O2(g)===2CO2 (g)+H2O (l);ΔH=2b kJ/mol O2(g)===2CO2 (g)+H2O (l);ΔH=2b kJ/mol |
| C.2C2H2(g)+5O2 (g)===4CO2 (g)+2H2O (l);ΔH=2b kJ/mol |
| D.2C2H2(g)+5O2 (g)===4CO2 (g)+2H2O (l);ΔH=b kJ/mol |
下列说法正确的是()
| A.原电池是把电能转化为化学能的装置 | B.形成原电池后,原电池中的阳离子移向正极 |
| C.原电池中电子流出的一极是正极 | D.原电池的两极发生的反应均为氧化还原反应 |
下列物质中,在一定条件下既能进行加成反应,也能进行取代反应,并且不能使KMnO4酸性溶液褪色的是( )
| A.乙烷 | B.乙烯 | C.乙醇 | D.苯 |
下列实验能获得成功的是( )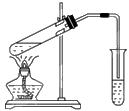
| A.用上图所示装置,无水乙酸和乙醇共热制取乙酸乙酯 |
| B.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复原来的红色 |
| C.用乙醇从碘水中萃取碘 |
| D.淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可看到有银镜出现 |
下列关于有机物的正确说法是( )
| A.等物质的量的CH4与Cl2恰好反应时,生成CH3Cl与HCl |
| B.煤干馏可得到大量汽油和煤油 |
| C.聚氯乙烯塑料最适合用来做蔬菜、水果及熟食等的保鲜膜 |
D.异丁烷(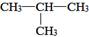 )与正丁烷互为同分异构体 )与正丁烷互为同分异构体 |