某同学在实验室欲配制物质的量浓度均为1.0 mol/L的NaOH溶液、稀硫酸各450 mL。提供的试剂是:NaOH固体、98%的浓硫酸(密度为1.84 g/cm3)和蒸馏水。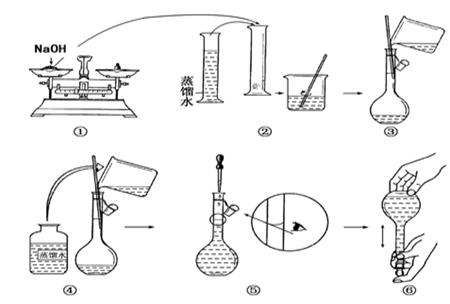
(1)请你观察图示判断其中不正确的操作有________(填序号)。
(2)应用托盘天平称量NaOH________g,应用量筒量取浓硫酸________mL。
(3)浓硫酸溶于水的正确操作方法是_____________________________。
(4)在配制上述溶液实验中,下列操作引起结果偏低的有________。
A该学生在量取浓硫酸时,俯视刻度线
B溶解硫酸后没有冷却至室温就立即完成后面的配制操作
C在烧杯中溶解搅拌时,溅出少量溶液
D没有用蒸馏水洗涤烧杯2~3次,并将洗液移入容量瓶中
E.将量筒洗涤2~3次,并全部转移至容量瓶中
F.容量瓶中原来存有少量蒸馏水
G.胶头滴管加水定容时俯视刻度
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)滴定终点时的现象为锥形瓶中的溶液由;
(2)滴定时边滴边摇动锥形瓶,眼睛应观察;
(3)该小组在步骤①中的错误是,由此造成的测定结果___________ (填偏高、偏低或无影响)
(4)步骤②缺少的操作是_______ ____
(5)右图,是某次滴定时的滴定管中的液面,其读数为___________mL;(上面数字:22,下面数字:23)。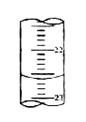
某学生为了使过滤操作能自动添加液体,设计了“自动加液过滤器”,如图所示.在倒置的烧瓶中盛放待过滤的液体,液体从“液体流出管”流入漏斗.为使液体顺利流下,还需插入“空气导入管”与大气相通.(空气导入管没有液体流出的可能)
(1)“空气导入管”下口应在A,上口应在C
| A.滤纸边沿下方 | B.滤纸边沿上方 |
| C.待过滤液液面上 | D.待过滤液中 |
E.A和B项均可 F.C和D项均可
(2)试简要说明自动加液过滤的原理.
试回答下列中学化学实验室中的有关问题:
(1)下列仪器中:①分液漏斗;②试剂瓶;③集气瓶;④滴瓶;⑤托盘天平;⑥容量瓶;⑦量筒;标有使用温度的仪器有。
(2)在仪器①漏斗;②容量瓶;③蒸馏烧瓶;④分液漏斗;⑤烧杯;⑥蒸发皿中,可用于粗盐提纯实验的有;可用于分离两种沸点接近且互不相溶的液态混合物实验的有。
(3)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在仪器①试管;②分液漏斗;③细口试剂瓶;④广口试剂瓶;⑤集气瓶;⑥滴瓶中,用到“磨砂”的有。
(4)在一次实验中,学生需要使用1.0mol·L-1的NaOH溶液460mL,在实验室配制溶液时回答如下问题:
①使用托盘天平称取NaOH固体g。
②误差分析:用字母填写A.偏大 B.偏小 C.无影响
Ⅰ.溶解后溶液未冷却至室温,就转移到容量瓶中,立即定容。则浓度。
Ⅱ.定容时俯视液面,则浓度。
某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2没有看到浑浊现象。经过思考分析,该同学改用图二的装置,将气体收集在注射器中,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,结果都能看到石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2快。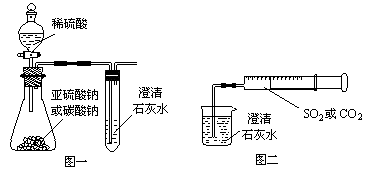
(1)若锥形瓶内装的是亚硫酸钠,写出锥形瓶内反应的化学方程式:_______________________________。
(2)对比分析两组实验,你认为用图一装置实验时,通入SO2不能出现浑浊的原因可能是_________________。写出此时试管内发生反应的总化学方程式:_____________________。
(3)用图二装置实验时,以相同速率通入CO2或SO2,SO2产生浑浊再变澄清的现象比CO2快,其原因是____________________________________。
(4)用图一进行SO2与石灰水反应的实验时,为防止SO2污染空气,应用盛有过量浓烧碱溶液的容器吸收SO2,写出容器内发生反应的离子方程式:。
下图表示实验室在没有通风橱的条件下制备氯气时设计的装置,图中a、b是可控制的弹簧铁夹。
(1)仪器A的名称是;水槽中应盛放的是;烧杯中反应的化学方程式;
(2)在收集氯气时,应。当氯气收集完毕时应。(填如何控制a、b)
(3)若要制得标准状况下的Cl20.672L,理论上需要MnO2的物质的量是mol。
(4)实验室也可在不加热的条件下用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
该反应中,氧化剂是,氧化产物是;当有1mol电子发生转移时,
生成氯气的体积为(标准状况),请用双线桥表示该氧化还原反应。
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O