(1)下图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3、KOH,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号:
①相连的两种物质都是电解质的是 (填分类标准代号,下同)都是氧化物的是 。
②图中相连的两种物质能够相互反应的是 ,所属基本反应类型的是 反应。
③上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,则该反应的离子
方程式为 。
④用洁净的烧杯取25 mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物
质的饱和溶液,加热煮沸至液体呈红褐色,得到的分散系称为 ,要证明该分散
系的实验的方法是 。
(2)分类方法应用比较广泛,属于同一类的物质具有相似性,在生活和学习中,使用分类的方法
处理问题可以做到举一反三,还可以做到由此及彼的效果。如:
①CO2、SiO2、SO2、SO3都属于酸性氧化物,由CO2+Ca(OH)2=CaCO3↓+H2O,可得出SO3
与NaOH反应的方程式 。
②NaHCO3、NaHSO3、NaHS都属于非强酸形成的酸式盐,由NaHCO3+HCl=NaCl+H2O+CO2↑、
NaHCO3+NaOH=Na2CO3+H2O,完成NaHS分别与HCl、NaOH反应的方程式为:
、 。
(8分)工业上制备BaCl2的工艺流程图如下: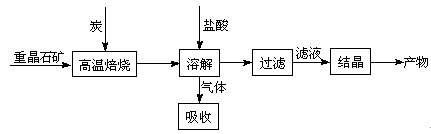
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)+4C(s)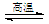 4CO(g)+BaS(s) DH1 = +571.2 kJ·mol-1 ①
4CO(g)+BaS(s) DH1 = +571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)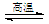 2CO2(g)+BaS(s) DH2= +226.2 kJ·mol-1 ②
2CO2(g)+BaS(s) DH2= +226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, =。
=。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)反应C(s)+CO2(g)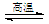 2CO(g)的DH2= kJ·mol-1。
2CO(g)的DH2= kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
,。
(12分)已知A为蓝色溶液,B、C、I、K为单质,其余均为化合物,其中B、L、I、K 常温下为气体,且I为有色气体。G为黑色固体,F的焰色反应透过蓝色钻玻璃片显紫色,各物质转化关系如图。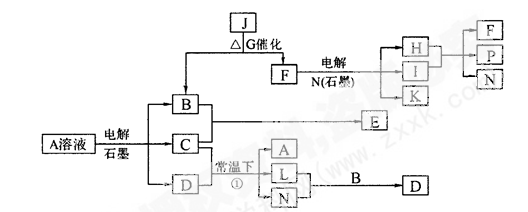
回答下列问题:
(1)P的电子式是_________________;
(2)C元素原子价电子排布式为:。
(3)已知B、H和C2H5OH能够组成燃料电池,写出该燃料电池的负极反应式:
_______________________________________________________________;
(4)A的水溶液呈___________(填“酸性”“碱性”“中性”),用离子方程式和必要的文字说明原因______________________________________________________________
(5)用惰性电极电解400.00 mL A溶液,一段时间内测得溶液pH=1,则需要向溶液中加入___________,其质量为______g,才能使溶液恢复到电解前的状态(不考虑溶液体积变化)。
(8分) X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
①X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是____________。
(2)Z2Y2与X2Y反应的化学方程式是__________________________________。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是____________(填写“正极”或“负极”)。
C(Ⅱ)的电极反应式是__________________________________。
(4)铜屑放入稀硫酸不反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是__________________________________。
(9分)如下图装置实验,A、B两烧杯分别盛放200 g10%NaOH和足量CuSO4溶液。通电一段时间后,c极上有Cu析出,又测得A杯中溶液的质量减少4.5 g(不考虑水的蒸发)。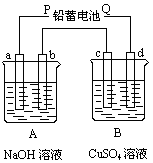
请回答下列问题:
(1)电源P极为 极;请分别写出b极和c极上发生的电极反应式:;
(2)c极上析出固体铜的质量为 g
(3)若装置中用铅蓄电池作电源,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
假设在a极制得气体0.050 mol,这时电池内消耗的H2SO4的物质的量至少是 mol
(9分) 某化学反应2A(g)  B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度均为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如下表:
B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度均为0,反应物A的浓度(mol•L-1)随反应时间(min)的变化情况如下表:
| 时间 实验序号 |
1 |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 1 |
800 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800 ℃ |
c2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800 ℃ |
c3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820 ℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)实验1中,在10~20 min时间内,以A的速率表示的平均反应速率为
mol•L-1•min-1。
(2)实验2中,A的初始浓度c2=mol•L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是。
(3)设实验3的化学反应速率为v3,实验1的化学反应速率为v1,则v3v1(填“>”“=”或“<”),且c3 =mol•L-1
(4)比较实验4和实验1,可推测该反应的正反应是反应(填“吸热”或“放热”),理由是。