有下列三个氧化还原反应
①2FeCl3+2KI=2KCl+2FeCl2+I2
②2Fe+3Cl2=2FeCl3
③2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是 ( )
| A.KMnO4 | B.Cl2 | C.HCl | D.FeCl3 |
有机化合物A的相对分子质量大 于110,小于150。经分析得知,碳和氢的质量分数之和为52.24%,其余为氧。请回答:
于110,小于150。经分析得知,碳和氢的质量分数之和为52.24%,其余为氧。请回答:
⑴该化合物分子中含有个氧原子。
⑵该化合物的摩尔质量是。
⑶化合物化学式为。
⑷该化合物分子中最多个羰基(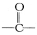 )
)
( 12 分)已知:
甲苯及其卤代物是有机化工的基本原料,由它出发可制造某些香料、药物及广泛应用于
印刷、电子工业中的感光树脂的重要中间体,它们之间的关系如下图所示: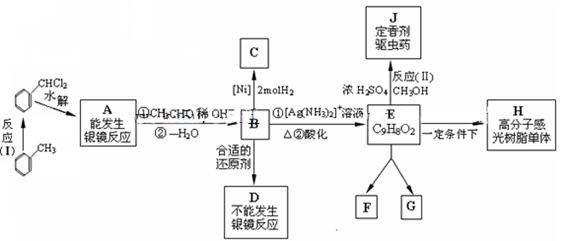
图中B、D、E都能使溴水褪色,E在光等辐射能 作用下可以发生二聚加成反应,生成互为同分异构体的环状化合
作用下可以发生二聚加成反应,生成互为同分异构体的环状化合 物F和G;E还可以在一定条件下形成一种优质高分子感光树脂的单体H。试回答:
物F和G;E还可以在一定条件下形成一种优质高分子感光树脂的单体H。试回答:
⑴写出 有机物的结构简式:A____________、C_____________、D_____________。
有机物的结构简式:A____________、C_____________、D_____________。
⑵反应(I)的类型是______________,反应(II)的类型是______________。
⑶完成化学方程式:A→B:____________________________________________。
⑷写出高分子感光树脂单体H的结构简式______________。
标准状况下,有A、 B、C三种气态烃组成的混合物共xmol,与足量氧气混合点燃完全燃烧后恢复原状况(标准状况)时,气体体积减少了44.8xL,则3种烃可能为
B、C三种气态烃组成的混合物共xmol,与足量氧气混合点燃完全燃烧后恢复原状况(标准状况)时,气体体积减少了44.8xL,则3种烃可能为
A.CH 4 C2H6 C3H8B.CH4 C2H4 C3H4
4 C2H6 C3H8B.CH4 C2H4 C3H4
C.C2H4 C 2H2 CH4D.C2H6 C3H6 C2H2
2H2 CH4D.C2H6 C3H6 C2H2
结构为 的有机物可以通过不同的反应得到下列四种物质:
的有机物可以通过不同的反应得到下列四种物质:
① ②
② ③
③ ④
④
生成这四种有机物的反应类型依次为:
| A.取代、消去、酯化、加成 | B.取代、消去、加聚、取代、 |
| C.酯化、取代、缩聚、取代 | D.酯化、消去、缩聚、取代、 |
某高聚物的结构片段如下,下列分析正确的是
| A.它是缩聚反应的产物 |
| B.其单体是CH2 |
| C.其链节是CH3CH2COOCH3 |
| D.其单体是CH2 |