(16分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
CO(g) +H2(g) ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是 。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
(2)已知,C(s)+ CO2(g) 2CO(g) △H=+172.5kJ•mol-1
2CO(g) △H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g) CO2(g)+H2(g) 的△H= kJ•mol-1。
CO2(g)+H2(g) 的△H= kJ•mol-1。
(3)CO与H2一定条件下反应生成甲醇(CH3OH),甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
| t / min |
2 |
4 |
7 |
9 |
| n(H2O)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
①其它条件不变,降低温度,达到新平衡前v(逆)_____v(正)(填“>”、“<”或“=”) 。
②该温度下,此反应的平衡常数K=__________;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),平衡时CO的体积分数______(填“增大”、“减小”或“不变”)。
资料一:考古工作者从安阳的商代铸铜遗址中,发现当时冶炼铜的主要矿物原料是孔雀石(Cu2(OH)2CO3),主要燃料是木炭,冶炼温度估计在1000 ℃左右。
资料二:西汉刘安著《淮南万毕术》中记载“曾青得铁则化为铜”。“曾青”可能是硫酸铜一类的物质,将孔雀石溶于硫酸中得此溶液,当把铁粉投入此溶液中即可得铜。
(1)关于“曾青”和孔雀石的水溶性分析中,判断正确的是( )
A.前者可溶,后者难溶 B.前者难溶,后者可溶
C.两者均可溶 D.两者均难溶
(2)以孔雀石为原料的冶炼过程中,用现代化学的观念审视,可能涉及的化学反应有( )
①Cu2(OH)2CO3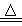 2CuO+CO2↑+H2O ②2CuO+C
2CuO+CO2↑+H2O ②2CuO+C  2Cu+CO2↑
2Cu+CO2↑
③CuO+CO Cu+CO2 ④CO2+C
Cu+CO2 ④CO2+C 2CO
2CO
A.①② B.①③ C.①②③ D.①②③④
(3)在(2)的四个反应中,不属于四种基本反应类型的有(填序号,下同)_________,不属于氧化还原反应的有___________。
(4)资料二中,假设溶解孔雀石的酸是稀硫酸,写出用此方法冶炼铜的化学方程式 , 。
用双线桥法分析下列反应:
(1)Fe+CuSO4=FeSO4+Cu
(2)Cl2+H2O=HClO+HCl
(3)5NH4NO3 2HNO3+4N2↑+9H2O
2HNO3+4N2↑+9H2O
(4)MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
| ① |
10 mL 2%H2O2溶液 |
无 |
| ② |
10 mL 5%H2O2溶液 |
无 |
| ③ |
10 mL 5%H2O2溶液 |
1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ |
10 mL 5%H2O2溶液+少量HCl溶液 |
1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ |
10 mL 5%H2O2溶液+少量NaOH溶液 |
1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是________(填一种即可)。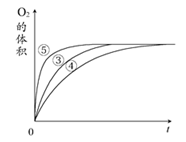
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。分析该图能够得出的实验结论是___________________。
Ⅱ.资料显示,某些金属离子对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图所示的实验装置进行实验。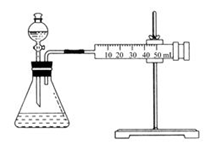
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量______或_______来比较;
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。解释反应速率变化的原因:________,计算H2O2的初始物质的量浓度为________。(保留两位有效数字,在标准状况下测定)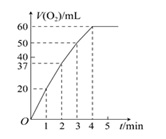
(3)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是________(填序号)。
A.化学反应速率理论可以指导怎样在一定时间内快出产品
B.勒夏特列原理可以指导怎样使有限原料多出产品
C.催化剂的使用是提高产品产率的有效办法
D.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
常温常压下,断裂1 mol(理想)气体分子化学键所吸收的能量或形成1 mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ·mol-1) 请根据下表一些键能数据完成下列问题。
| 化学键 |
键能 |
化学键 |
键能 |
化学键 |
键能 |
| C-F |
427 |
C-Cl |
330 |
C-I |
218 |
| H-H |
436 |
S=S |
255 |
H-S |
339 |
(1)由表中数据规律预测C-Br键的键能范围:________<C-Br键能<________(填写数值和单位)。
(2)已知下列热化学方程式:
O2 (g) = O2+(g)+e- ΔH1= +1 175.7 kJ/mol
PtF6(g)+e-= PtF6-(g) ΔH2= —771.1 kJ/mol
O2+PtF6-(s) = O2+(g)+PtF6-(g) ΔH3= +482.2 kJ/mol
则反应O2(g) +________(g)=O2+PtF6-(s) ΔH=________kJ·mol-1。
在一定条件下,可逆反应:mA+nB pC达到平衡状态。
pC达到平衡状态。
(1)若A、B、C都是气体,减小压强,平衡向正反应方向移动,则m+n和p的关系是________。
(2)若A、C是气体,增加B的量,平衡不移动,则B的状态为______________。
(3)若A、C是气体,而且 m+n=p,增大压强可使平衡发生移动,则平衡向________(填“正”或“逆”)反应方向移动。
(4)若加热后,可使C的质量增加,则正反应是________(填“放热”或“吸热”)反应。