(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。
②写出该反应的离子方程式 。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,操作为:
①配制250 mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: 。当____ ,证明达到滴定终点。
③计算:再重复上述操作2次,记录实验数据如下。
| 序号 |
滴定前读数(mL) |
滴定后读数(mL) |
| 1 |
0.00 |
20.10 |
| 2 |
1.00 |
20.90 |
| 3 |
0.00 |
22.10 |
则消耗KMnO4溶液的平均体积为 mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为 。
④误差分析:下列操作会导致测定结果偏高的是__________。
A 未用标准浓度的酸性KMnO4溶液润洗滴定管
B 滴定前锥形瓶有少量水
C 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视
某研究性学习小组用右图所示装置进行下列实验,请回答:
(1)若a中为浓H2SO4,b中为Na2SO3,c中为品
红溶液。先打开活塞K,从分液漏斗放出部分
溶液至烧瓶中,反应一段时间后,可观察到c
中的现象是 ,b中反应停止再关闭K,
向烧杯d中加入沸水,可观察到c中的现象是
;
(2)烧瓶中发生反应的化学方程式为 ;
(3)若实验室用上述装置制取氧气,则b中的试剂
为(填化学式) ,a中的试剂
是 ,反应的化学方程式为 。
为了测定Na2CO3与Na2SO3混合物中各组分的含量,取样品23.2g以下图所示装置(铁架台、铁夹等仪器未在图中画出)进行实验: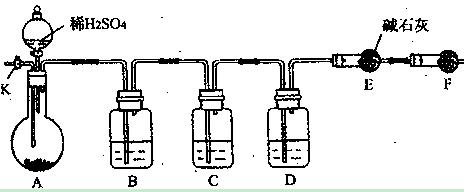
(1)将仪器连接好以后,必须进行的第一步操作是;
(2)装置B的作用是 ;
;
(3)已知装置C中装有品红溶液, 其作用是;
其作用是;
(4)实验室中备有以下常用试剂:a.浓硫酸 b. 品红溶液 c. 酸性高锰酸钾溶液
d. 饱和碳酸氢钠溶液 e. 氢氧化钠溶液 f. 无水硫酸铜 g. 碱石灰
请将下列装置中应盛放的试剂的序号填在横线上:
B中应盛放,D中应盛放,F中应盛放;
(5)若装置E在实验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为。
请按要求分别设计一个简单易行的验证实验。
(1)验证钠和镁的金属性强弱;
(2)验证硫和氯的非金属性强弱。
现在V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20,其中V的一种原子的原子核内没有中子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍,Y元素原子最外层电子数是X元素原子最外层电子数的两倍;X、Z是金属元素,Z的核外电子排布与Ar原子相同。请回答:
(1)V是,X是,Z是(填元素符号)
(2)Y在周期表中的位置是;
(3)V和W形成V2W型化合物的电子式为,所含的化学键类型为;
(4)用电子式表示Z和Y形成化合物的过程是。
现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素形成的一种化合物为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4克C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素符号:B,C;
(2)画出A2-的离子结构示意图:,
指出D在周期表的位置: ;
;
(3)写出B的呈淡黄色的化合物与CO2反应的化学方程式:;
(4)比较D的气态氢化物与H2S和HF的稳定性:(用化学式表示);
(5)用电子式表示C与D形成化合物的过程:。