某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过虑,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中( )
| A.至少存在5种离子 | B.Cl--一定存在,且c(Cl‑)≥0.4mol/L |
| C.SO42-、NH4+一定存在,Cl-可能不存在 | D.CO32-、Al3+一定不存在,K+可能存在 |
下列说法正确的是
| A.1mol葡萄糖可与5mol乙醇发生酯化反应 |
| B.油脂氢化、氨基酸形成多肽、蛋白质水解都属于取代反应 |
| C.可用碘水和银氨溶液鉴别葡萄糖、麦芽糖和淀粉三种物质 |
D.乙二醇、甲醛、α-羟基丙酸( )都可发生缩聚反应 )都可发生缩聚反应 |
下列化学反应得出的结论不正确的是
| 化学反应 |
结 论 |
|
| A |
2Na + 2H2 O=2NaOH + H2↑ 4Na + O2= 2Na2O |
Na应隔绝空气,密封保存 |
| B |
CO32- + 2H+=CO2 ↑+ H2O |
遇强酸产生大量CO2的溶液中一定含有大量CO32- |
| C |
Al2O3+ 6H+=2Al3+ + 3H2O Al2O3+ 2OH-=2AlO2-+ H2O |
Al2O3是两性氧化物 |
| D |
CO2(少量) +H2O+ C6H5O-→HCO3-+C6H5OH |
相同温度时,电离出H+的能力: H2CO3 > C6H5OH> HCO3- |
下列说法不正确的是
| A.用电解法精炼粗铜的时候纯铜做阳极 |
| B.将镁块与钢铁输水管相连,可以防止钢铁腐蚀 |
| C.熔融烧碱的时候,不能使用石英坩埚 |
| D.可以用硫酸或者CO2中和碱性废水 |
据中国卫生部通报,中国内地已有多例H7N9流感确诊病例。达菲是治疗H7N9型流感的有效药物,莽草酸是合成达菲的重要原料,它们的结构简式如下图,下列关于这两种有机化合物的说法正确的是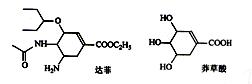
| A.莽草酸不能使溴水褪色 |
| B.都能发生水解反应 |
| C.达菲的分子式为C16H28O4N2 |
| D.1 mol莽草酸能与4mol NaOH反应 |
参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的
HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的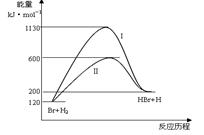
| A.反应热:过程I>过程Ⅱ |
| B.反应速率:过程Ⅱ=过程I |
| C.该反应为吸热反应 |
| D.过程I使用了催化剂 |