(1)相同物质的量浓度、相同体积的NaCl、MgCl2、AlCl3溶液,分别与足量的AgNO3溶液反应,生成沉淀的质量之比为________。
(2)向等体积、等浓度的AgNO3溶液中,分别加入相同体积的NaCl、MgCl2、AlCl3溶液,恰好使它们中的Cl-完全转化为AgCl沉淀,则三种溶液的物质的量浓度之比为________。
(3)Na、Mg、Al分别与足量的硫酸溶液反应,当生成气体的质量相同时,消耗Na、Mg、Al的物质的量之比为________。
(4)足量的Al分别与等浓度的硫酸、氢氧化钠溶液反应,当生成气体的质量相同时,硫酸溶液和氢氧化钠溶液的体积比为________。
高锰酸钾是锰的重要化合物和常用的氧化剂,工业用软锰矿制备高锰酸钾的实验流程如下:
(1)上述流程中可以循环使用的物质有(写化学式)
(2)从经济环保角度考虑,要完全反应b需要的试剂最好是,并写出相应的化学方程式。
(3)高锰酸钾是氧化还原滴定分析时常用的一种试剂,在滴定操作时,应将高锰酸钾标准溶液盛放在(填“酸式”或“碱式”)滴定管中,用酸性KMnO4溶液滴定硫酸亚铁晶体(FeSO4•7H2O)溶液, 写出滴定反应的离子方程式。
(4)KMnO4、双氧水、活性炭常用于饮用水的处理,但三者在联合使用时必须有先后顺序。①氧化反应:H2O2 - 2e- → 2H+ + O2↑;还原反应:MnO4- + 5e- + 8H+ → Mn2+ + 4H2O
写出该氧化还原反应的化学方程式。
②在处理饮用水时,活性炭应在高锰酸钾反应结束后投放,否则会发生KMnO4+ C+ H2O→MnO2 + X + K2CO3(未配平),其中X的化学式为。
已知X、Y、Z、W、N是短周期元素中的四种元素,它们的原子序数依次增大.X元素的原子形成的离子就是一个质子,Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍,工业上常用电解w与N的化合物来制备N单质。
(1)请写出Z在元素周期表中的位置________。化合物甲由元素X与Z组成,1mol甲含18mol电子,请写出甲的电子式:;
(2)元素N的一种常见的可溶性盐溶液呈碱性,其原因是(用离子方程式表示):;
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,其离子方程式为。
(4)已知离子化合物乙由X、Y、Z、W四种元素组成,乙既能与盐酸反应,又能与NaOH溶液反应,1mol 乙能与过量NaOH浓溶液反应,最多可生成22.4L气体(标准状况)。写出加热条件下乙与过量NaOH溶液反应的离子方程式。
(5)乙溶液中所有离子的浓度等式表达式为。
Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下: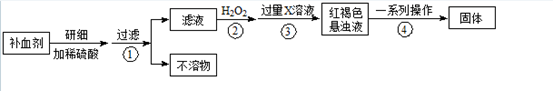
请回答下列问题:
(1)步骤②加入过量H2O2的目的:;
(2)步骤③中反应的离子方程式:;
(3)步骤④中一系列处理的操作步骤:、洗涤、、冷却、称量。
(4)实验中用浓硫酸配制1 mol/L的稀硫酸,配制时用到定量的玻璃仪器有、
(答出两个仪器)。
(5)若实验无损耗,则每片补血剂含铁元素的质量g(用含a的代数式表示)。
(1)① 写出Na2SO4的电离方程式。
② 氧化铝和氢氧化钠溶液反应的离子反应方程式。
③ OH- + H+ ="=" H2O改写为化学方程式。
(2)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用,①Na2CO3、②NaOH、③BaCl2、④HCl ,用序号表示加入的先后顺序是。
(3)下列实验操作中不正确的是(多选)。
| A.用分液的方法分离水和汽油的混合物 |
| B.用过滤的方法分离饱和食盐水与沙子的混合物。 |
| C.蒸馏时,应使温度计水银球插入液面以下 |
| D.蒸发结晶时应将溶液蒸干后再停止加热 |
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
已知:H2O2具有较强的氧化性,一些较不活泼金属在稀硫酸存在的情况下,能和H2O2发生氧化还原反应。根据下列框图回答问题:(M、E等字母用所对应的元素符号表示)
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式:。
(2)某同学取X的溶液,加入少量稀硫酸酸化后露置于空气中一段时间,颜色变黄,再加入KI、淀粉溶液,又变为蓝色。分别写出上述变黄过程和变蓝过程所发生相关反应的离子方程式:、。
(3)写出Y到Z变化过程的离子方程式:。
(4)写出Cl2将Z氧化为K2EO4的化学方程式:。