金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
(1)工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为
;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为 mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
(2)铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。
计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。
已知测定过程中发生的反应如下:
①2Cr3+ + 3S2O82-+ 7H2O Cr2O72-+ 6SO42-+ 14H+
Cr2O72-+ 6SO42-+ 14H+
②Cr2O72-+ 6I-+ 14H+ 2Cr3+ + 3I2 + 7H2O
2Cr3+ + 3I2 + 7H2O
③I2 + 2S2O32- 2I-+ S4O62-
2I-+ S4O62-
现有下列五个转化,其中不可能通过一步反应实现的是
①SiO2 Na2SiO3
Na2SiO3
②CuSO4 CuCl2
CuCl2
③SiO2 H2SiO3
H2SiO3
④CuO Cu(OH)2
Cu(OH)2
⑤Ca3(PO4)2 Ca(H2PO4)2
Ca(H2PO4)2
| A.①和② | B.③和④ |
| C.②③和④ | D.②③④和⑤ |
下列离子方程式书写不正确的是
A.往NaOH溶液中通入过量CO2 |
B.单质硅与烧碱溶液反应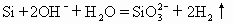 |
C.石英砂与烧碱反应制水玻璃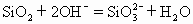 |
| D.往水玻璃中通入二氧化碳 |
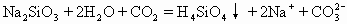
将过量的CO2通入下列溶液中,最终出现浑浊的是
| A.CaCl2溶液 | B.石灰水 |
| C.饱和Na2CO3溶液 | D.水玻璃 |
下列说法正确的是
| A.二氧化硅溶于水显酸性 |
| B.光导纤维传导光的能力非常强,利用光缆通讯,能同时传送大量信息 |
| C.因为高温时二氧化硅与碳酸钠反应放出CO2,所以硅酸的酸性比碳酸强 |
| D.二氧化硅是酸性氧化物,它不溶于任何酸。 |