在0.1 mol·Lˉ1醋酸溶液中加入少量0.1 mol·Lˉ1盐酸,下列叙述正确的是 ( )
| A.CH3COOH的电离度减小,pH减小 |
| B.平衡向生成CH3COOH方向移动,c(H+)减小 |
| C.CH3COOH的电离度增大,c(H+)增大 |
| D.电离平衡向生成CH3COOˉ、H+方向移动,pH减小 |
某烃结构如下: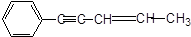 ,有关其结构说法正确的是()
,有关其结构说法正确的是()
| A.所有原子可能在同一平面上 | B.所有原子可能在同一条直线上 |
| C.所有碳原子可能在同一平面上 | D.所有氢原子可能在同一平面上 |
下列物质的沸点按由高到低的顺序排列正确的是()
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
| A.②④①③ | B.④②①③ | C.④③②① | D.②④③① |
下列各组物质中,属于同系物的是()
A. CH2=CH-COOH,CH3-CH2-CH2-COOH
B. 乙烷,2,2,3,3—四甲基丁烷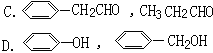
下列四种烃的名称所表示的物质,命名正确的是()
| A.2-甲基-2-丁炔 | B.2-乙基丙烷 |
| C.3-甲基-2-丁烯 | D.2-甲基-2-丁烯 |
下列分子式表示的物质,具有同分异构体的是()
| A.C3H7Cl | B.C3H8 | C.CH2Cl2 | D.CH4O |