下列化学反应中,离子方程式表示正确的是( )
| A.少量金属钠加到冷水中:Na+2H2O = Na++OH-+H2↑ |
| B.铁粉加到盐酸中:2Fe+6H+ = 2Fe 3++3H2↑ |
| C.石灰石溶解在稀HCl中:CO32-+ 2H+ = CO2↑+ H2O |
D.硫酸溶液与氢氧化钡溶液混合:Ba2+ +2OH-+SO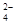 +2H+ =2H2O+ Ba SO4↓ +2H+ =2H2O+ Ba SO4↓ |
下列说明不正确的是 ( )
| A.防晒剂分为有机防晒剂和无机防晒剂 |
| B.防晒剂的防晒功能主要体现在可以散射或吸收紫外线 |
| C.尽可能在不同场所中使用SPF高的防晒霜 |
| D.SPF值越高的防晒霜对紫外线的防护效果越好 |
下列过程中,不涉及化学变化的是()
| A.甘油加水作护肤剂 |
| B.用明矾净化水 |
| C.烹鱼时加入少量的料酒和食醋可减少腥味,增加香味 |
| D.烧菜用过的铁锅,经放置常出现红棕色斑迹 |
下列物质属于非离子型表面活性剂的是()
| A.烷基硫酸钠 | B.甜菜碱类化合物 |
| C.高级醇聚氧乙烯加成 | D.烷基三甲基氯化铵 |
下列对于杀虫剂认识不正确的是()
| A.杀虫剂逐渐向着无毒、无污染方向发展 |
| B.气雾类杀虫剂不应靠近火源,防止爆炸 |
| C.超高效杀虫剂之所以高效是因为他的毒性更强 |
| D.有机磷等杀虫剂虽然杀虫效果好,但有一定的残留,所以使用时要慎重 |
下列说法正确的是()
| A.不同类型的洗涤剂混合使用能够增加其洗涤效果 |
| B.不同的消毒剂混合使用能够增加其消毒功能 |
| C.天然的洗涤剂的去污效果比合成的好 |
| D.增白洗涤剂中的增白剂本身没有去污能力 |