下列说法正确的是
| A.HNO3的摩尔质量为63 |
| B.摩尔是物质的量的单位 |
| C.1 mol任何物质都约含有6.02×1023个原子 |
| D.64 g SO2中含有1mol O2 |
下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是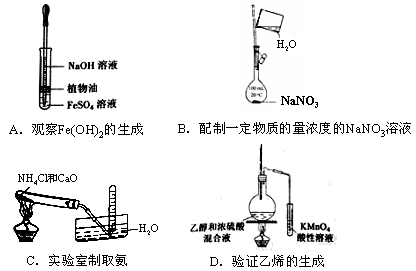
下列叙述正确的是
| A. | 稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B. | 25℃时,等体积等浓度的硝酸与氨水混合后,溶液 =7 |
| C. | 25℃时,0.1 的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
| D. | 0.1 和0.1 混合后加入1 水中,所得溶液中 |
下列说法正确的是()
| A. | 的原子半径大于 , 比 的热稳定性强 |
| B. | 的非金属性强于 , 比 的酸性强 |
| C. | 和 均可与 溶液反应 |
| D. | 和 混合气体通入 溶液可得到 和 |
中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是()
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 |
| C. | 烧结粘土制陶瓷 | D. | 打磨磁石制指南针 |
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程: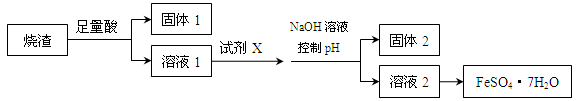
下列说法不正确的是
| A.溶解烧渣选用足量硫酸,试剂X选用铁粉 |
| B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 |
| C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 |
| D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O |