x 、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知
| A.x的原子半径大于y的原子半径 |
| B.x的电负性大于y的电负性 |
| C.x阴离子的半径小于y阳离子的半径 |
| D.x的第一电离能小于y 的第一电离能 |
下列事实、事件、事故中与甲烷无关的是
| A.天然气的主要成分 | B.石油经过催化裂化的产物 |
| C.“西气东输”中气体 | D.煤矿中的瓦斯爆炸 |
某同学取一定量某工厂所排废水试样,进行如下实验: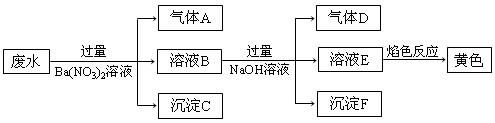
已知废水试样中可能含有下表离子中的若干种:
| 阳离子 |
Ba2+、K+、NH4+、Fe2+、Fe3+、X |
| 阴离子 |
CO32-、SO32-、NO3-、Y |
下列判断不正确的是
A.离子X是H+,离子Y是SO42-
B.不能确定NO3-是否存在于废水中
C.沉淀C是纯净物
D.废水中一定存在Fe2+、NH4+,可能存在K+
室温下,0.1mol·L-1的下二元酸H2A溶液中,溶液合体系可能存在的含A粒子(H2A、HA-、A2-)所点物质的量分数(δ)随pH变化的关系如图所示,下列说法正确的是
A.H2A的电离方程式:H2A H+ + HA-
H+ + HA-
B.pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100
C.物质的量浓度NaHA和Na2A溶液等体积混合,离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D.Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+2c(H2A),各粒子浓度均大于0
硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如下。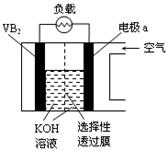
该电池工作时总反应为:4VB2 + 11O2= 4B2O3 + 2V2O5。下列说法正确的是
| A.硼化钒(VB2)为电池的正极 |
| B.电池持续反应过程中,选择性透过膜只能用阳离子交换膜 |
| C.电路中通过1mole−时消耗硼化钒6.6g |
| D.VB2极发生的电极反应为:2VB2 + 28OH--22e−= 2VO3- + 4B(OH)4-+ 6H2O |
下列说法正确的是
A.按系统命名法,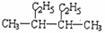 的名称是2,3-二甲基已烷 的名称是2,3-二甲基已烷 |
| B.石油裂解可以得到乙烯,煤干馏得到的煤焦油中可以提取苯,乙烯和苯使溴水褪色的原理相同 |
| C.已知蔗糖与脂肪酸经酯化反应可合成蔗糖酯,据此可知蔗糖酯在稀硫酸的作用下充分水解可生成三种产物 |
| D.CHFCl2、CHClF2都有两种同分异构体,都是曾广泛使用的制冷剂——氟里昂 |