如图所示,△H1="-393.5kJ/mol," △H2=-395.4kJ/mol,下列说法或表示式正确的是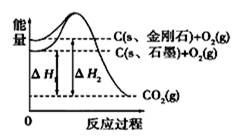
| A.石墨和金刚石的转化是物理变化 |
| B.C(s、石墨)=C(s、金刚石) △H="+1.9" kJ/mol |
| C.金刚石的稳定性强于石墨 |
| D.断裂1mol石墨化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少 |
在1200。C时,天然气脱硫工艺中会发生下列反应
H2S(g)+3/2O2(g)=SO2(g)+H2O(g)△H1
2H2S(g)+SO2(g)= 3/2S2(g)+2H2O(g)△H2
H2S(g)+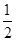 O2(g)=S(g)+H2O(g)△H3
O2(g)=S(g)+H2O(g)△H3
2S(g) =S2(g)△H4
则△H4的正确表达式为
| A.△H4=2/3(△H1+△H2-3△H3) | B.△H4=2/3(3△H3-△H1-△H2) |
| C.△H4=2/3(△H1+△H2-2△H3) | D.△H4=2/3(△H1-△H2-3△H3) |
已知温度T时水的离子积常数为KW,该温度下,将浓度为amol·L-1的一元酸HA与bmol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)= 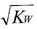 mol.L-1 mol.L-1 |
| D.混合溶液中c(H+)+c(B+)=c(OH-)+C(A-) |
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
| A.c(H+) | B.K电离(HF) |
| C.c(F-)/c(H+) | D.c(H+)/c(HF) |
下图表示反应

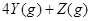 ,
,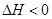 ,在某温度时
,在某温度时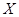 的浓度随时间变化的曲线:
的浓度随时间变化的曲线: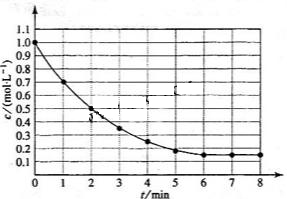
下列有关该反应的描述正确的是
A.第6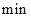 后,反应就终止了 后,反应就终止了 |
B.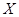 的平衡转化率为85% 的平衡转化率为85% |
C.若升高温度,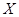 的平衡转化率将大于85% 的平衡转化率将大于85% |
| D.若降低温度,v正和v逆将以同样倍数减少 |
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g) 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是
A.该反应的化学平衡常数表达式是K=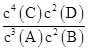 |
| B.此时,B的平衡转化率是40% |
| C.增大该体系的压强,化学平衡常数增大 |
| D.增加B,B的平衡转化率增大 |