短周期主族元素A、B、C、D、E的原子序数依次增大,其中只有C是金属元素,B是地壳中含量最多的元素,A元素常见化合价为+1和-1;A与C的最外层电子数相同,C、D两元素原子的电子数之和为A、B两种元素原子的电子数之和的3倍。下列叙述正确的是()
A.元素的原子半径:A<B<C< D< E
B.对应氢化物的热稳定性:D > E
C.B与C、B与D形成的化合物中化学键类型相同
D.五种元素中最高价氧化物对应的水化物酸性最强的是E
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq)。某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
I3-(aq)。某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是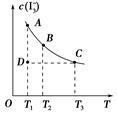
A.反应I2(aq)+I-(aq) I3-(aq)的ΔH>0 I3-(aq)的ΔH>0 |
| B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2 |
| C.若反应进行到状态D时,一定有v正<v逆 |
| D.状态A与状态B相比,状态A的c(I2)大 |
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是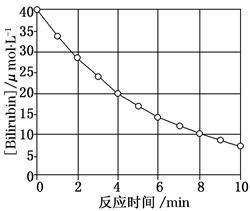
| A.2.5 μmol·L-1·min-1和2.0 μmol·L-1 |
| B.2.5 μmol·L-1·min-1和2.5 μmol·L-1 |
| C.3.0 μmol·L-1·min-1和3.0 μmol·L-1 |
| D.5.0 μmol·L-1·min-1和3.0 μmol·L-1 |
对可逆反应2A(s)+3B(g)  C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v (正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
| A.①② | B.④ | C.③ | D.④⑤ |
依据下表判断CH3CH3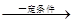 CH2=CH2+H2的反应热为
CH2=CH2+H2的反应热为
| 化学键 |
C-H |
C=C |
C-C |
H-H |
| 键能(kJ·mol-1) |
414.4 |
615.3 |
347.4 |
435.3 |
A.125.6kJ·mol-1B.-125.6kJ·mol-1
C.46.1kJ·mol-1D.-46.1kJ·mol-1
工业制氢气的一个重要反应是: 已知在25℃时:
已知在25℃时: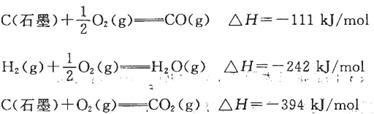
则2 5℃时1 mol CO与水蒸气作用转化为氢气和二氧化碳反应△H为
| A.+41.kJ/mol | B.-41kJ/mol | C.283kJ/mol | D.-131kJ/mol |