物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是( )
| A.①②③⑤ | B.①②⑤ | C.②⑤⑥ | D.①④⑤⑥ |
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,依据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020 mol·L-1的NaHSO3溶液(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55 ℃间溶液变蓝时间,55 ℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断不正确的是
| A.40 ℃之前与40 ℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B.图中b、c两点对应的NaHSO3的反应速率相等 |
| C.图中a点对应的NaHSO3的反应速率为5.0×10-5 mol·(L·s)-1 |
| D.温度高于40 ℃时,淀粉不宜用作该实验的指示剂 |
燃料电池不是把还原剂、氧化剂全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池。下面有4种燃料电池的工作原理示意图,其中正极的反应产物为水的是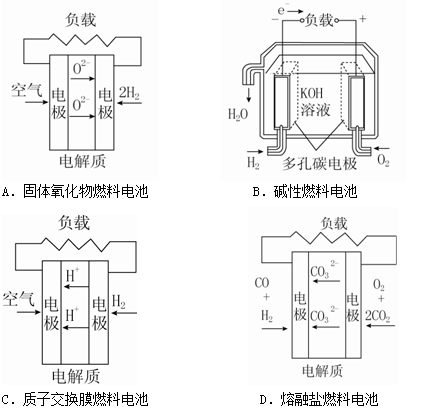
下列有关反应热的叙述中正确的是
①已知2H2(g)+O2(g)="==" 2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为△H=-241.8 kJ·mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g) Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:
| 共价键 |
C—C |
C===C |
C—H |
H—H |
| 键能/(kJ·mol-1) |
348 |
610 |
413 |
436 |
上表数据可以计算出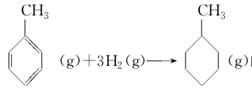 的焓变
的焓变
⑤根据盖斯定律,推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2固体时,放出的热量相等
⑥25℃,101 kPa时,1 mol碳完全燃烧生成CO2所放出的热量为碳的燃烧热
A.①②③④B.③④⑤C.④⑤D.⑥
某同学设计如下元素周期表,以下说法正确的是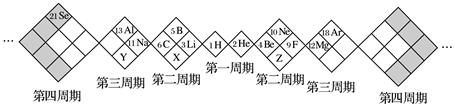
| A.X、Y、Z元素分别为N、P、O |
| B.白格中都是主族元素,灰格中都是副族元素 |
| C.原子半径:Z>X>Y |
| D.X、Y、Z的气态氢化物中最稳定的是X的氢化物 |
根据转化关系判断下列说法正确的是
| A.(C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体 |
| B.可以利用银镜反应证明反应①的最终产物为葡萄糖 |
| C.酸性高锰酸钾可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中也可得到乙酸 |
| D.在反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯 |