肼(N2H4)是火箭发射常用的燃料。一种以肼(N2H4)为燃料的电池装置如图所示。该燃料电池的电极材料采用多孔导电材料,以提高电极反应物在电极表面的吸附量,并使它们与电解质溶液充分接触,以空气中的氧气作为氧化剂,KOH溶液作为电解质。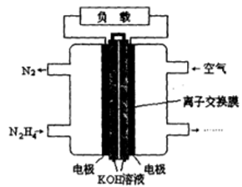
(1)负极上发生的电极反应为_________________;
(2)电池工作时产生的电流从_______电极经过负载后流向________电极(填“左侧”或“右侧”)。
(3)放电一段时间后,右侧溶液的pH (填“变大”或“变小”)
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤ ▲。
⑥ ▲。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:▲ 。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是: ▲。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp= 2.64×10−39)。下列说法正确的是 ▲(选填序号)。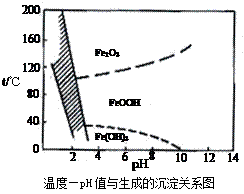
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10−29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钢,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是: ▲。
(5)补充上述步骤⑤和⑥(可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸)。
A、B、C、D、E、F和G都是有机化合物,它们的关系如下图所示:
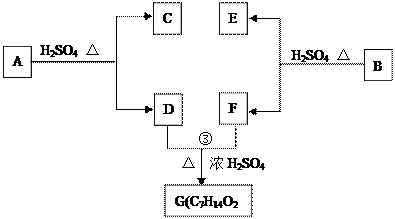
(1)化合物C的分子式是C7H8O ,C遇FeCl3溶液显紫色,核磁共振氢谱表明C分子中有4种不同化学环境的氢,则C的结构简式为_______。
,C遇FeCl3溶液显紫色,核磁共振氢谱表明C分子中有4种不同化学环境的氢,则C的结构简式为_______。
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为___________,D具有的官能团名称是_____________。
(3)反应①的化学方程式是______________________________________________。
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是______________________________________。
(5)E可能的结构简式是_____________________。
(6分) 某溴代烃A的相对分子质量为123,其中溴的质量分数为65.04%,则该溴代烃A的分子式为,该溴代烃A在NaOH溶液中加热后转化成有机物B,B在Cu催化作用下被氧化成C,C能发生银镜反应,则A B的反应类型为反应,C发生银镜反应的化学方程式为:。
B的反应类型为反应,C发生银镜反应的化学方程式为:。
2008年9月29日,“神舟”七号飞船返回舱着陆。我国首次真正意义上有人参与的空间飞行试验取得圆满成功。“神七”有一室一厅,其环境舒适程度优于“神六” 。为使航天员拥有一个稳定的、良好的生存环境,一般在飞船内装有“金属过氧化物处理系统”,即不断地把座舱内的空气通过盛放金属过氧化物(以Na2O2为例)的装置,并把处理后的气体充入座舱内。
。为使航天员拥有一个稳定的、良好的生存环境,一般在飞船内装有“金属过氧化物处理系统”,即不断地把座舱内的空气通过盛放金属过氧化物(以Na2O2为例)的装置,并把处理后的气体充入座舱内。

(1)写出有关反应的方程式:_____________________,______________________。
(2)有人认为如用KO2(超氧化钾)代替Na2O2也能达到同样的目的(生成物也相似)并具有优越性。写出超氧化钾与CO2反应的化学方程式:_________________________。
某烷烃的结构简式为CH3CH(CH3)CH2CH2C(CH3)3,按系统命名法,该烷烃的名称为,若该烷烃是炔烃与氢气加成反应的产物,则该炔烃的结构有种。