在80 g密度为d g·cm-3的硫酸铁溶液中,含有2.8 g Fe3+,则此溶液中SO的物质的量浓度为(单位为mol·L-1)
| A.15d/16 | B.5d/16 | C.3d/8 | D.5d/8 |
如图所示,a、b是两根石墨棒。下列叙述正确的是
| A.a是正极,发生还原反应 |
| B.b是阳极,发生氧化反应 |
| C.稀硫酸中硫酸根离子的物质的量不变 |
| D.往滤纸上滴加酚酞试液,a极附近颜色变红 |
在真空恒容密闭容器中盛有1 mol PCl5加热到200℃时发生的如下反应:
PCl5(气)  PCl3(气) +Cl2(气),反应达平衡后,PCl5所占体积分数为M%。若在同一温度和同一容器中,最初投入的是2 mol PCl5(气),反应达平衡时,PCl5所占体积分数为 N%。则M和N的正确关系是
PCl3(气) +Cl2(气),反应达平衡后,PCl5所占体积分数为M%。若在同一温度和同一容器中,最初投入的是2 mol PCl5(气),反应达平衡时,PCl5所占体积分数为 N%。则M和N的正确关系是
| A.M>N | B.M<N | C.M="N" | D.无法比较 |
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系是:v(正)>v(逆) |
在一真空密闭容器中,通入一定量气体A在一定条件下,发生如下反应:
2A(g) 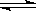 B(g) + xC(g),反应达平衡时,测得容器内压强增大为P%,若此时A的转化率为a%,下列关系正确的是()
B(g) + xC(g),反应达平衡时,测得容器内压强增大为P%,若此时A的转化率为a%,下列关系正确的是()
| A.若x=1,则P=a | B.若x=2,则P=a |
| C.若x=3,则P=a | D.若x=4,则P=a |
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
| A.1/2N2H4(g)+O2(g)====1/2N2(g)+1/2H2O(g);ΔH=+267 kJ·mol-1 |
| B.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH =-534 kJ·mol-1 |
| C.N2H4(g)+O2(g)====N2(g)+2H2O(g);ΔH =+534 kJ·mol-1 |
| D.N2H4(g)+O2(g)====N2(g)+2H2O(l);ΔH =-133.5 kJ·mol-1 |