下列各组离子在对应溶液中可能大量存在的是
| A.水电离出的c(H+)=10-12mol·L-1的溶液:K+、Cu2+、SO32-、MnO4- |
| B.与铝粉反应能放出氢气的溶液:Na+、SO42-、HCO3-、Cl- |
| C.含有大量ClO-的溶液:H+、I-、SO42-、Cl- |
| D.pH=12的溶液:K+、Cl-、SO32-、SiO32- |
香叶醇是合成玫瑰香油的主要原料,其结构简式如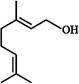
下列有关香叶醇的叙述正确的是:
| A.香叶醇的分子式为C10H18O |
| B.不能使溴的四氯化碳溶液褪色 |
| C.不能使酸性高锰酸钾溶液褪色 |
| D.能发生加成反应不能发生取代反应 |
某溶液中含有较大量的四种离子,在其中加入稀硫酸后它们的物质的量几乎不发生变化。这四种离子可能是
| A.Na+、Ag+、ClO—、Cl— |
| B.Al3+、Mg2+、Br—、Cl— |
| C.NH4+、NO3—、Fe2+、SO42— |
| D.K+、Ba2+、NO3—、OH— |
下列说法不科学的是:
| A.臭氧是饮用水的理想消毒剂之一,原因是臭氧杀菌能力强且又不影响水质 |
| B.“水滴石穿”主要是溶解CO2的雨水与CaCO3长期作用生成可溶性的Ca(HCO3)2的缘故 |
| C.实验室用“通风橱”防污染是不环保的做法,实验产生的有害气体并没得到转化或吸收 |
| D.变质的油脂有难闻的气味,是由于油脂与水发生了水解反应 |
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应 设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。下列叙述中正确的是
设计成的原电池装置,其中C1、C2均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40% NaOH溶液。下列叙述中正确的是
| A.甲组操作时,电流计(G)指针发生偏转 |
| B.乙组操作时,C2做正极 |
| C.乙组操作时,C1上发生的电极反应为:I2+2e-===2I- |
| D.甲组操作时,溶液颜色变浅 |
下列解释实验事实的化学方程式正确的是
A.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀: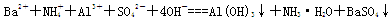 |
| B.KMnO4和H2O2在酸性条件下反应:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O |
| C.在电解质溶液为氢氧化钾的甲醇燃料电池内电路中,负极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D.向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32- |