海洋中蕴藏着丰富资源,对它的开发利用有利于缓解当前资源紧张的困局,工业上从海水中提取的某些无机物的简易流程可以用下图表示: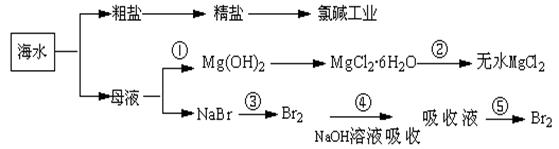
下列有关说法不正确的是
| A.氯碱工业中采用阳离子交换膜电解槽,可以防止氯气与碱的反应 |
| B.第②步中结晶出的MgCl2·6H2O不能采用直接在空气中受热分解制无水MgCl2 |
| C.第①步常采用往母液中加浓NaOH溶液来获取Mg(OH)2 |
| D.从第③步到第⑤步的目的是获得含溴单质浓度较高的溶液 |
用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的种类数为
| A.3 | B.4 | C.5 | D.6 |
下列各组物质中,每种物质各取1 mol,在足量的氧气中燃烧,两者耗氧量不相同的是
| A.乙烯和乙醇 | B.乙炔和乙醛 |
| C.乙烷和乙酸甲酯 | D.乙醇和乙酸 |
下列除去杂质的方法,正确的是
| A.除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离 |
| B.除去乙醇中少量乙酸:加入碳酸钠溶液,分液 |
| C.除去FeCl3溶液中少量的CuCl2:加入过量铁粉,过滤 |
| D.除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液 |
1999年,在欧洲一些国家发现饲料被污染,导致畜禽类制品及乳制品不能食用,经测定饲料中含有剧毒物质二恶英,其结构为 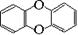 ,已知它的二氯代物有10种,则其六氯代物有
,已知它的二氯代物有10种,则其六氯代物有
| A.15种 | B.11种 | C.10种 | D.5种 |
关于某有机物的性质叙述正确的是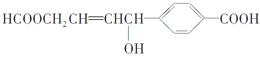
| A.1 mol该有机物可以与3 mol Na发生反应 |
| B.1 mol该有机物可以与3 mol NaOH发生反应 |
| C.1 mol该有机物可以与6 mol H2发生加成反应 |
| D.1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等 |