(12分)硫酸锌是制备荧光粉的原料之一。工业上由锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4•7H2O的流程如下:
已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式开始沉淀的pH分别为:2.7,5.4,7.6;完全沉淀的pH分别为:3.7,6.5,9.7。
(1)下列能提高浸取过程中浸出效率的措施有
| A.将矿石粉碎 | B.提高浸取温度 | C.适当增加硫酸的浓度 | D.搅拌并适当延长浸取时间 |
ZnO和硫酸反应的离子方程式为
(2)加入适量锌粉后溶液中存在的金属阳离子主要有
(3)氧化过程中H2O2发生反应的化学方程式为
(4)加入适量Ca(OH)2调节溶液pH至 ~ (填范围),促进Fe3+水解完全。Fe3+水解反应的平衡常数表达式K=
某化工厂联合生产纯碱、镁、阻燃剂。以白云石(CaCO3·MgCO3)为原料冶炼镁:经高温煅烧生成的氧化物在还原炉中经1200℃用硅铁还原生成镁蒸汽(铁化合价不变),镁蒸汽经冷凝为粗镁;同时以海水为原料制碱和制阻燃剂。具体流程如下: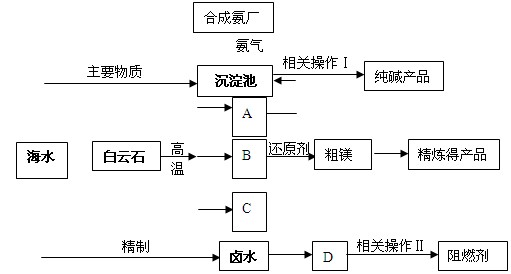
(1)分别写出A、B、C的化学式、、;沉淀池中反应的化学方程式是。
(2)硅铁还原生成镁蒸汽时选择低压和1200℃,试分析选择这种反应条件的原因
。
(3)精制卤水中的MgCl2与适量石灰乳反应生成碱式氯化镁[Mg(OH)Cl]沉淀,此时溶液中主要溶质是(写化学式)。
(4)描述流程中相关操作Ⅰ包括过滤、、。
(5)已知:Mg(OH)2(s)→MgO(s)+H2O(g)-81.5kJ;Al(OH)3(s)→0.5Al2O3(s)+1.5 H2O(g)-87.7kJ
①Mg(OH)2能起阻燃作用,其原因是。
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是。
(6)某化工厂利用上图所示流程联合生产纯碱、镁、阻燃剂,试分析该生产的优点
。
大气固氮(闪电时N2转化为NO)和工业固氮(合成氨)是固氮的重要形式。下表列举了不同温度下大气固氮和工业固氮的部分K值(K表示平衡常数):
N2+O2 2NO 2NO |
N2+3H2 2NH3 2NH3 |
|||
| 温度 |
25℃ |
2000℃ |
25℃ |
400℃ |
| K |
3.84×10-31 |
0.1 |
5×108 |
200 |
(1)固氮是指的过程,自然界固 氮的另一途径为。
氮的另一途径为。
(2)根据表中的数据,并结合所学知识分析,下列说法正确的是。
a.人类大规模模拟大气固氮实际意义很小
b.常温下,大气固氮与工业固氮完成程度相差很大
c.两种固氮都是放热反应 d.在常温下,大气固氮几乎不可能,而工业固氮很容易进行
(3)为研究反应条件的改变对化学平衡移动的影响,将N2和H2在一固定体积的密闭容器中进行反应,得到如下的图像。下列有关条件改变(每次只改变一个条件)的说法,正确的是。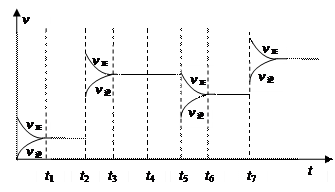
a.t2可能是增加了原料的物质的量
b.t4可能是充入了He气
c.t5是从反应体系中分离出氨气
d.t7时可能是升高温度,使平衡向正反应方向移动
(4)目前工业固氮采用的是哈伯法,即在20~50MPa的高压和500℃左右的 高温下,并用铁触媒作为催化剂。俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)的新催化剂,在常温下合成氨,反应的化学方程式为:N2 +3H2
高温下,并用铁触媒作为催化剂。俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)的新催化剂,在常温下合成氨,反应的化学方程式为:N2 +3H2 2NH3。有关说法正确的是。
2NH3。有关说法正确的是。
a.新法不需要高温条件,可节约大量能源
b.新法能在常温下进行是因为不需要断裂化学键
c.在相同温度下不同的催化剂其催化活性不同
已知溶液中:还原性HSO3->I-,氧化性IO3-> I2 > SO42-。在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题: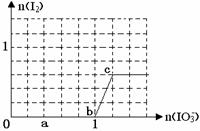
(1)写出a点反应的离子方程式;
反应中还原剂是;被还原的元素是。
(2)写出b点到c点反应的离子方程式。
(3) 当溶液中的I-为0.4 mol时,加入的KIO3为mol。
当溶液中的I-为0.4 mol时,加入的KIO3为mol。
(4)若往100 mL1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为
。
下表为元素周期表短周期的一部分。回答下列问题:
| A |
D |
|||
| E |
G |
M |
(1)E元素原子核外有2个未成对电子,这2个电子所处亚层的符号是;请从物质的类别、化合价二方面归纳该元素+4价氧化物的化学性质:。
(2)请指出G的非金属性比E的非金属性强的事实(写3)。 (3)E、G元素的原子均可形成与M原子电子层结构相同的简单离子,且E离子的半径更大,请解释。
(3)E、G元素的原子均可形成与M原子电子层结构相同的简单离子,且E离子的半径更大,请解释。
(4)A与氢元素形成分子的空间结构可能是(选填序号)。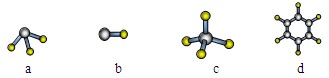
有浓度为0.1 mol•L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol·L-1,b mol·L-1,c mol·L-1,其大小顺序为__________。
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为
n 1mol,n2 mol,n3 mol,它们的大小关系为____________。
(3)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为____________。
(4)与锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为____________。