(共10分)向200 mL ,某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________;如果是多种成分,可能是__________________________ 。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式___________________________________________________________________。
②B点时,反应所得溶液中溶质的物质的量浓度是__________ (溶液体积的变化忽略不计)。
(1)向H2O2溶液中滴加FeCl3溶液,可发生下列反应:
H2O2+2Fe3+=2Fe2++ O2↑+2H+, H2O2+ 2Fe2++2H+=2Fe3++ 2H2O 。
在以上反应中Fe3+实际上起着 作用,总反应式为 。
(2)I2与Fe3+一样也可以发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:
H2O2+I2=2HIO, 。
总反应式为 。
(3)在硫酸和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色。该反应的离子方程式为: 。
(4)铁酸钠(Na2FeO4)可作为一种新型净水剂,在反应中Na2FeO4被还原为Fe3+离子,请简述铁酸钠之所以能净水,除了具有强氧化性,能消毒杀菌外,另一原因是
。
(5)铁酸钠的制备常用氧化铁在碱性溶液中与硝酸钠反应制得:
Fe2O3 + NaNO3 + NaOH → Na2FeO4 + NaNO2 + H2O
配平化学方程式,并标出电子转移的方向和数目。
已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75% ,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为无色液体。反应生成的水均已略去。它们有如下图所示的关系。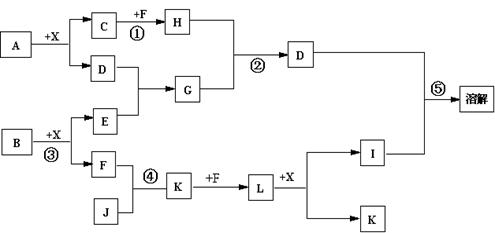
(1)写出化学式:A B J 。
(2)反应③中每生成1molF,转移电子的数目为:。
(3)反应④的化学方程式为:。
(4)离子方程式分别为:反应② ;
⑤ 。
(5)反应①中,每1.00gC与足量的F作用,恢复到25oC放出55.6kJ热量,写出反应①的热化学方程式 。
写出C6H14主链上有4个碳原子的所有的同分异构体
(每空1分,共11分)写出有关离子方程式
(1)Na2SO4溶液中滴加Ba(OH)2:
(2)H2S的电离方程:
(3)NH4Cl溶液显性:
(4)纯碱溶液显性:
(5)将FeCl3饱和溶液滴入沸水中:
(6)用明矾净水:
(7)在配制AlCl3溶液时,为了防止发生水解,可以加入少量的;在配制FeSO4溶液时,为了防止溶液变质,可以加入少量的和。
(每空2分,共8分)
(1)用系统命名法给烷烃 命名:
命名:
(2)写出些列有关化学方程式
①实验室制取乙炔:
②乙烯通入溴水中:
3有乙烯制取聚乙烯: