化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是 
| A.N2(g)+3H2(g)=2NH3(l) ΔH=2(a-b-c)kJ·mol-1 |
| B.N2(g)+3H2(g)=2NH3(g) ΔH=2(b-a)kJ·mol-1 |
C.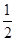 N2(g)+ N2(g)+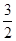 H2(g)=NH3(l) ΔH=(b+c-a)kJ·mol-1 H2(g)=NH3(l) ΔH=(b+c-a)kJ·mol-1 |
D.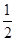 N2(g)+ N2(g)+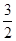 H2(g)=NH3(g) ΔH=(a+b)kJ·mol-1 H2(g)=NH3(g) ΔH=(a+b)kJ·mol-1 |
一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(g)+2B(g) C(g) +D(g),当下列物理量不再发生变化时,不能表明该反应达到平衡状态的是
C(g) +D(g),当下列物理量不再发生变化时,不能表明该反应达到平衡状态的是
| A.混合气体密度 | B.容器内气体的压强 |
| C.混合气体的平均相对分子质量 | D.A的转化率 |
室温下向10mL0.1 mol•L-1NaOH溶液中加入0.1 mol•L-1的一元酸HA溶液,pH的变化曲线如图所示。下列说法正确的是
A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A-)>c(HA)
D.滴定过程中不可能出现c(Na+)>c(OH-)>c(A-)>c(H+)
下列指定反应的离子方程式不正确的是
| A.硫代硫酸钠溶液与稀硫酸混合:S2O32-+2H+=S↓+SO2↑+H2O |
| B.向CuSO4溶液中通入H2S气体:Cu2++S2-=CuS↓↑ |
| C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl- |
D.重铬酸钾的溶液中存在着如下平衡:Cr2O72-(橙红色)+H2O 2H++2CrO42-(黄色) 2H++2CrO42-(黄色) |
给定条件下,下列选项中所示的物质间转化均能一步实现的是
A.粗硅 SiCl4 SiCl4 Si Si |
B.Mg(OH)2 NgCl2(ag) NgCl2(ag)  Mg Mg |
C.Fe2O3 FeCl3(ag) FeCl3(ag)  无水FeCl3 无水FeCl3 |
D.Cu NO2 NO2 NO NO |
NA为阿伏加德罗常数的值,下列说法正确的是
| A.某密闭容器盛有0.2molSO2和0.1molO2,在一定条件下充分反应,转移电子的数目为0.4NA |
| B.标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为NA |
| C.1L0.1mol/LCuCl2溶液中含有Cu2+离子数小于0.1NA |
| D.1mol/L醋酸溶液中含有的H+离子数小于NA |