(6分)请写出下列反应的化学方程式:
(1)实 验 室 制 取 乙 炔 的 化 学 方 程 式 是 。
(2)乙醇的催化氧化: 。
(3)写出由苯丙烯( 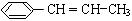 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式:
。
甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.电池的总反应式为2CH3OH+3O2+4OH-═2CO +6H2O.则下列说法正确的是
+6H2O.则下列说法正确的是
| A.电池放电时通入空气的电极为负极 |
| B.电池放电时负极的电极反应式为CH3OH-6e-+H2O═CO2↑+6H+ |
C.由于CO 水解显碱性,电池放电时,电解质溶液的pH逐渐增大 水解显碱性,电池放电时,电解质溶液的pH逐渐增大 |
| D.电池放电时每消耗1molCH3OH转移6mol电子 |
下列有关金属腐蚀与防护的说法正确的是
| A.黄铜(铜锌合金)制作的铜锣易产生铜绿 |
| B.镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁中铁的腐蚀速率更快 |
| C.在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫阳极电化学保护法 |
| D.不锈钢有较强的抗腐蚀能力是因为在钢铁表面上镀上了铬 |
常温时,Ksp[Mg(OH)2] = 1.1×10-11,Ksp(AgCl) = 1.8×10-10,Ksp(Ag2CrO4) = 1.9×10-12 Ksp(CH3COOAg) = 2.3×10-3,下列叙述不正确的是
| A.浓度均为0.2mol·L-1AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 |
| B.将0.001mol·L-1的AgNO3溶液滴入0.001mol·L-1的KCl和0.001mol·L-1的K2CrO4的混合溶液中,先产生Ag2CrO4沉淀 |
| C.c(Mg2+)为0.11mol·L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 |
| D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
向体积为Va的0.05 mol·L-1CH3COOH溶液中加入体积为Vb的0.05 mol·L-1KOH溶液,下列关系错误的是
| A.Va>Vb时:c(CH3COOH)+c(CH3COO-)>c(K+) |
| B.Va=Vb时:c(CH3COOH)+c(H+)=c(OH-) |
| C.Va<Vb时:c(CH3COO-)>c(K+)>c(OH-)>c(H+) |
| D.Va与Vb任意比时:c(K+)+c(H+)=c(OH-)+c(CH3COO-) |
化学家们合成了一种新物质——五星烷,其键线式如图所示(已知:CH2CH=CH2CHO的键线式为: )。下列有关五星烷的说法正确的是
)。下列有关五星烷的说法正确的是
| A.五星烷与乙烷互为同系物 |
| B.五星烷的化学式为C15H20 |
| C.五星烷分子中含有7个五元环 |
| D.五星烷的一氯代物有三种 |