物质的量浓度相等的下列溶液pH值由大到小的顺序是( )
| A.Na2CO3、NaHCO3、NaCl、NH4Cl | B.Na2CO3、NaHCO3、NH4Cl、NaCl |
| C.Na2CO3、NaCl、NH4Cl、NaHCO3 | D.Na2CO3、NH4Cl、NaHCO3、NaCl |
我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。这一材料是由华信塑业发展有限公司最新研发成功的新材料,并成为公安部定点产地。PETG的结构简式为: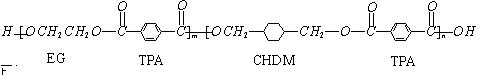
下列判断正确的是 ()
| A.PETG是有机高分子化合物 | B.PETG是通过加聚反应生产的 |
| C.该物质易溶解于水 | D.该物质是体型结构的高分子 |
乙烯雌酚是人工合成的激素类药物,能改善体内激素的平衡状态,破坏肿瘤组织赖以生长发育的条件,对治疗前列腺癌和乳腺癌有明显的疗效,其结构如下图,下列有关叙述中不正确的是[]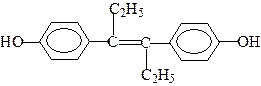
| A.乙烯雌酚的分子式为C18H20O2 |
| B.该有机物分子中最多可能有18个碳原子共平面 |
| C.乙烯雌酚可与NaOH、NaHCO3、Br2反应 |
| D.该有机物与葡萄糖可用银氨溶液鉴别 |
从中草药菌陈蒿中提取出的乙羟基苯乙酮是一种利胆的有效成份,其结构简式如下: 推测该物质不具有的化学性质是[ ]
推测该物质不具有的化学性质是[ ]
A.能与碳酸氢钠反应 B.能与氢氧化钠反应
C.能与浓溴水反应 D能与H2反应,还原为醇类物质
化学工作者和社会各界都一直关注食品安全问题,目前国内的“三鹿毒奶粉”事件是不法奶商向原奶中加入了三聚氰胺,其结构简式如右下图。已知氨分子为三角锥型,下列关于三聚氰胺的说法不正确的是[ ]
| A.含有不饱和碳原子,在一定条件下能发生加成反应 |
| B.不法分子因为三聚氰胺含氮量较高才用其造假 |
| C.分子中所有原子都在同一平面上 |
| D.在一定条件下能发生氧化反应 |
【四川泸州市高2009级第二次诊断性考试理科综】某有机物结构简式为:有关它的说法正确的是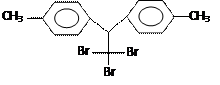
| A.它属于芳香烃 | B.分子式为C16H14Br3 |
| C.分子中最多有24个原子共面 | D.1mol该物质能与6mol H2加成 |