部分弱酸的电离平衡常数如下表:
| 弱酸 |
HCOOH |
HCN |
H2CO3 |
| 电离常数(25℃) |
Ka=1.77×10-4 |
Ka=4.9×10-10 |
Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列选项错误的是( )
A.CN―+H2O+CO2=HCN+HCO3―
B.2HCOOH+CO32―=2HCOO―+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
北京大学和中国科学院的化学工作者合作已成功研制出碱金属与C60形成的球碳盐K3C60.实验测知该物质属于离子晶体,且有良好的超导性,下列K3C60的组成和结构的分析正确的是
| A.K3C60中既有离子键,又有共价键,在熔融状态下能导电 |
| B.1molK3C60中含有的离子键的数目为63×6.02×1023 |
| C.K3C60的摩尔质量是837 |
| D.该物质的化学式可定成KC20 |
运用元素周期律分析下面推断,其中错误的是
| A.第ⅠA族元素铯(Cs)能与水剧烈反应并放出氢气 |
| B.第ⅢA族元素铊(Tl)的最高价氧化物的水化物的碱性:Tl(OH)3> Al(OH)3 |
| C.第ⅥA族元素硒(Se)的氢化物的稳定性:H2Se > H2O |
| D.第ⅦA族元素砹(At)为有色固体,难与氢气化合 |
将 H2S、 SO2、 SO3 各0.01mol依次溶解于1L水中,则该溶液具有
| A.中性、漂白性 | B.酸性、漂白性 | C.只有酸性 | D.只有漂白性 |
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是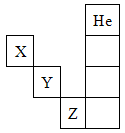
①X的气态氢化物与Y的最高价氧化物对应的水化物所生成的盐属于离子化合物
②Y、Z的气态氢化物的水溶液的酸性Y<Z
③Z的单质在常温下是液体,可与镁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有18种元素
| A.①②③④ | B.①②③④⑤ | C.只有③⑤ | D.只有①④ |
学生用滤纸折成一只纸蝴蝶并在纸蝴蝶上喷洒某种试剂,挂在铁架台上。另取一只盛有某种溶液的烧杯,放在纸蝴蝶的下方(如图)。过一会儿,发现纸蝴蝶的颜色由白色转变为红色,喷洒在纸蝴蝶上的试剂与小烧杯中的溶液是
| A |
B |
C |
D |
|
| 纸蝴蝶上的喷洒液 |
石蕊 |
酚酞 |
酚酞 |
石蕊 |
| 小烧坏中的溶液 |
浓盐酸 |
浓氨水 |
氢氧化钠溶液 |
浓硫酸 |