室温下,某无色透明溶液中由水电离出来的H+和OH—浓度的乘积为1×10—24,则此溶液中可能大量共存的离子组为( )
| A.HCO3-、Al3+、Na+、SO42- | B.I-、NO3-、K+、NH4+ |
| C.MnO4-、Cl-、SO42-、K+ | D.SiO32-、SO32-、Na+、Cl- |
已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
| A.该溶液的pH=4 |
| B.升高温度,溶液的pH增大 |
| C.此酸的电离平衡常数约为1×10-7 |
| D.由HA电离出的c(H+)约为水电离出的c(H+)的106倍 |
对室温下氢离子浓度、体积均相同的HCl溶液和CH3COOH溶液分别采取以下措施,有关叙述正确的是( )
| A.加适量的CH3COONa晶体,两溶液的氢离子浓度减小 |
| B.使温度升高20 ℃,两溶液的氢离子浓度不变 |
| C.加水稀释2倍,两溶液的氢离子浓度增大 |
| D.加足量的Zn充分反应后,两溶液中产生的氢气一样多 |
下列关于电解质溶液的叙述正确的是( )
A.常温下,由0.1 mol·L-1一元碱BOH溶液的pH=10,可推知BOH溶液存在:BOH B++OH- B++OH- |
| B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) |
| C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 |
| D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:
①NaCN+HNO2=HCN+NaNO2,
②NaCN+HF=HCN+NaF,
③NaNO2+HF=HNO2+NaF。
由此可判断下列叙述中,不正确的是( )
| A.HF的电离平衡常数为7.2×10-4 |
| B.HNO2的电离平衡常数为4.9×10-10 |
| C.根据①③两个反应即可知三种酸的相对强弱 |
| D.HNO2的电离平衡常数比HCN大,比HF小 |
0.1 mol·L-1氨水10 mL,加蒸馏水稀释到1 L后,下列变化中正确的是( )
①电离程度增大;②c(NH3·H2O)增大;③NH4+数目增多;④c(OH-)增大;⑤导电性增强;⑥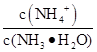 增大
增大
| A.①②③ | B.①③⑤ | C.①③⑥ | D.②④⑥ |