(1)某温度下,纯水中的c(H+)=2.0×10—7mol/L,此时溶液的c(OH—)= mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10—4mol/L,则溶液中c(OH—)= mol/L,由水电离产生的c(H+)= mol/L,此时温度 25℃(填“高于”、“低于”或“等于”)。
(2)室温时,将pH=5的H2SO4稀释10倍,则c(H+)∶c(SO42—)= ,将稀释后的溶液再稀释1000倍,则c(H+)∶ c(SO42—)= 。
(3)有稀硫酸和稀盐酸的混合溶液20ml,向此溶液中滴加0.025mol/LBa(OH)2溶液时,生成沉淀的质量和溶液pH的变化情况如图所示,求: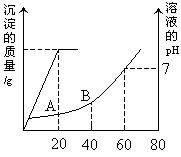
⑴原混合溶液中硫酸和盐酸的物质的量浓度?
⑵滴到A、B两点时溶液的pH 各是多少?
有①质子数②中子数③核外电子数④价电子数⑤最外层电子数⑥电子层数。请用上述序号回答:
(1)原子种类由决定,元素种类由决定。
(2)原子的质量数由决定,元素在周期表中的位置由决定。
已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
写出X、Y、Z、W四种元素的名称:
X、Y、Z、W
下表标出的是元素周期表的一部分元素,回答下列问题: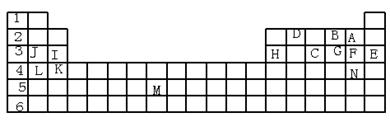
(1)表中用字母标出的14种元素中,化学性质最不活泼的是(用元素符号表示,下同),主族元素中金属性最强的是,非金属性最强是,常温下单质为液态的非金属元素是;属于过渡元素的是(该空用字母表示)。
(2)B、F、C气态氢化物的化学式分别为,
其中以最不稳定。
(3)第三周期中原子半径最小的是。
写出下列物质的电子式和结构式
(1)O2电子式:,结构式:
(2)H2S电子式:,结构式:
写出下列物质的电子式
(3)NaCl电子式:
(4)MgCl2电子式:
请填写下列空白
(1)原子由原子核和构成,原子核由和构成,
带(填质子中子或电子,下同)电(填正或负,下同),带电。
(2)在原子中,原子序数===。
(3)化学键可以分为键和键,键又可以分为极性和非极性。
(4)化学反应究竟要吸收能量还是要放出能量,主要取决于。化学反应的能量变化通常表现为热量的变化。若反应物总能量(填大于、小于或等于,下同)生成物总能量,为放热反应,若反应物总能量生成物总能量,为吸热反应。
(5)烷烃的概念:烃分子中碳原子之间都以碳碳结合成,剩余价键均与原子结合,使每个碳原子的化合价都达到“”,这样的烃又叫做“”。