下列实验操作:①用50 mL量筒量取5 mL蒸馏水;②称量没有腐蚀性固体药品时,把药品放在托盘上称量;③浓硫酸稀释后冷却至室温再转移至容量瓶中;④倾倒液体时试剂瓶口不对准容器口;⑤块状药品都要用药匙取用;⑥固体药品用细口瓶保存.其中错误的是
| A.①②③ | B.③④ | C.②⑤⑥ | D.①②④⑤⑥ |
将Na2O2投入FeCl2溶液中, 可观察到的现象是()
| A.生成白色沉淀、有气泡产生 | B.生成红褐色沉淀、有气泡产生 |
| C.生成浅绿色沉淀、有气泡产生 | D.生成黑色沉淀,有气泡产生 |
下表是某人体检的部分指标,其中是用物质的量浓度来表示的是()
| A.甘油三酯 | B.谷丙转氨酶 | C.肌酸磷酸激酶 | D.白蛋白 |
下列说法正确的是()
| A.摩尔质量就是相对分子质量 | B.摩尔是物质的量的单位 |
| C.H2SO4的摩尔质量是98 g | D.1 mol H2的质量是2 g/mol |
下列各组物质中化学键的类型相同的是()
| A.HCl MgCl2 NH4Cl | B.NH3 H2O CO2 |
| C. CaCl2 NaOH H2O | D.H2O Na2O? CO2 |
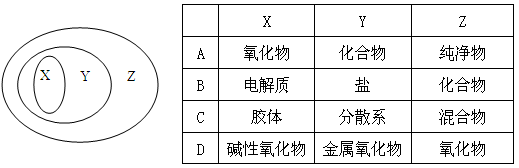
用如图表示的一些物质或概念间的从属关系中不正确的是()