有五瓶溶液分别是:①l0mL0.60mol•L-1 NaOH水溶液,②20mL0.50 mol•L-1H2SO4。③30mLO .4 mol•L-1 HCl④40mL0.30 mol•L-1CH3COOH水溶液,⑤50mL0.20 mol•L-1蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是
| A.①>②>③>④>⑤ | B.②>①>③>④>⑤ | C.②>③>④>①>⑤ | D.⑤>④>③>②>① |
下列叙述错误的是:
| A.用金属钠可区分乙醇和乙醚 |
| B.用高锰酸钾酸性溶液可区分乙烷和乙烯 |
| C.用水可区分苯和溴苯 |
| D.用新制的银氨溶液可区分甲酸甲酯和乙醛 |
有机物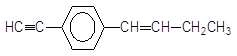 最多可能有多少个碳原子共面:
最多可能有多少个碳原子共面:
| A.12 | B.11 | C.10 | D.9 |
下列有机物在与浓硫酸混合共热的条件下能够生成烯烃的是:
| A.CH3CH2Br | B.(CH3)3CCH2OH | C.CH3CH2OH | D.CH3OH |
下列离子方程式正确的是:
A.足量的乙酸与碳酸钠溶液反应:2H++CO —→CO2↑+H2O —→CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应: 2CH3COOH+Cu(OH)2—→Cu2++2CH3COO-+2H2O |
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O 2C6H5OH+CO 2C6H5OH+CO |
| D.甲醛溶液与足量的银氨溶液共热 |
HCHO+2[Ag(NH3)2]++2OH- CO
CO +2NH
+2NH +Ag↓+3NH3+H2O
+Ag↓+3NH3+H2O
下列说法中正确的是:
| A.不粘锅的涂层是聚四氟乙烯,聚四氟乙烯可以发生加成反应 |
| B.只有与卤原子相连的碳的邻位碳上有氢的卤代烃才能发生水解反应 |
| C.可以用硝酸酸化的硝酸银溶液直接与卤代烃混合的方法判断卤原子的种类 |
| D.溴乙烷在与氢氧化钠的乙醇溶液共热时会发生消去反应 |