某温度下,将Cl2通入KOH溶液中得KCl、KClO3和KClO的混合溶液。经测定ClO3-和ClO-物质的量之比为2:1,则反应中被还原的Cl2与被氧化Cl2的物质的量之比为 ( )
| A.2:3 | B.3:4 | C.11:3 | D.10:3 |
下表中列出了25℃、101kPa时一些物质的燃烧热数据
| 物质 |
CH4 |
C2H2 |
H2 |
| 燃烧热/kJ/mol |
890.3 |
1299.6 |
285.8 |
已知键能:C—H键:413.4 kJ/mol、H—H键:436.0 kJ/mol。
则下列叙述正确的是
A.C≡C键能为796.0 kJ/mol
B.C—H键键长小于H—H键
C.2H2(g)+O2(g)=2H2O(g)△H=﹣571.6 kJ/mol
D.2CH4(g)=C2H2(g) +3H2(g) △H=﹣376.4 kJ/mol
短周期主族元素X、Y、Z、W的原子序数依次增大,X、Y、Z原子序数之和是W的2倍,X、Z在周期表中的相对位置如图所示,X的最低负价绝对值与其原子最外层电子数相等。下列说法不正确的是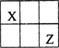
| A.原子半径:Y>Z>W | B.一定条件下,Y可置换出X |
| C.气态氢化物稳定性:Z>W | D.熔点YW2>XW4 |
雌二醇和炔雌醇是两种雌激素用药,它们的结构简式如下,关于它们的说法不正确的是
| A.核磁共振氢谱峰数相同 |
| B.均能发生加成反应、取代反应、消去反应 |
| C.两种分子中所有碳原子不可能在同一个平面内 |
| D.可用FeCl3溶液鉴别 |
下列实验装置能达到实验目的的是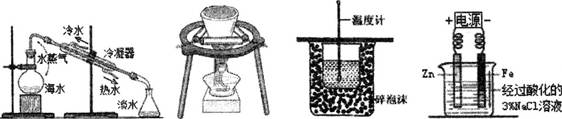
| A.海水蒸馏 | B.钾在空气中的燃烧 | C.测定中和热 | D.牺牲阳极的阴极保护法 |
下列解释实验过程或事实的反应方程式不正确的是
A.熔融烧碱时,不能使用氧化铝坩埚:Al2O3+2NaOH 2NaAlO2+H2O 2NaAlO2+H2O |
| B.刻制印刷电路时用FeCl3溶液作为“腐蚀液”:2Fe3++Cu=Cu2++2Fe2+ |
C.打磨后的镁条置于沸水中,滴加酚酞溶液变红色:Mg+2H2O(g)  Mg(OH)2+H2↑ Mg(OH)2+H2↑ |
| D.向KI溶液中滴加硫酸酸化的双氧水,溶液呈棕黄色:2I﹣+H2O2+2H+=I2+O2↑+2H2O |