肼(N2H4)—空气燃料电池是一种环保碱性燃料电池,其电解质溶液是20%—30%的KOH溶液。电池总反应为:N2H4+O2=N2↑+2H2O。下列关于该燃料电池工作时的说法正确的是( )
| A.溶液中阴离子物质的量基本不变 |
| B.正极的电极反应式是:O2+4H++4e-=2H2O |
| C.正极的电极反应式是:N2H4+4OH――4e-=H2O+N2↑ |
| D.溶液中阴离子向正极移动 |
在一定温度下,氯化银在水中存在如下沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq),若把AgCl分别放入①100mL0.1mol/LNa2SO4溶液中;②100mL0.1mol/L NaCl溶液中;③100mL0.1mol/L AlCl3溶液中;④100mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
Ag+(aq)+Cl-(aq),若把AgCl分别放入①100mL0.1mol/LNa2SO4溶液中;②100mL0.1mol/L NaCl溶液中;③100mL0.1mol/L AlCl3溶液中;④100mL0.1mol/L MgCl2溶液中。搅拌后在相同的温度下Ag+浓度由大到小的顺序是:
| A.①>②>④>③ | B.②>①>④>③ | C.④>③>②>① | D.①>④>③>② |
某氨水的pH=X,某盐酸的pH=Y,已知X+Y=14,将上述氨水与盐酸等体积混合后,所得溶液中各种离子浓度的关系正确的是 ( )
A.c( )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
B.c(Cl-)>c( )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
C.c(Cl-)>c( )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
D.c( )+c(H+)=c(Cl-)+c(OH-) )+c(H+)=c(Cl-)+c(OH-) |
为了使Na2S溶液中c(Na+)/c(S2-)的比值变小,可加入的物质是()
| A.适量盐酸 | B.适量NaOH | C.适量KOH | D.适量KHS |
一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:2SO2+O2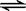 2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是()
2SO3,平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是()
| A.2 mol SO2+ 1 mol O2 | B.4 mol SO2+ 1 mol O2 |
| C.2 mol SO2+ 1 mol O2+ 2 SO3 | D.3 mol SO2+ 0.5 mol O2+ 1 SO3 |
下列溶液,阴离子总浓度最大的是( )
| A.0.2 mol / L NaCl | B.0.1 mol / L Ba(OH)2 |
| C.0.2 mol / L K2S | D.0.2 mol / L (NH4)2SO4 |