某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g) 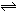 2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是
| A.若T2>T1,达到平衡时b、d点的反应速率为vd>vb |
| B.若T2>T1,则正反应一定是放热反应 |
| C.达到平衡时A2的转化率大小为b>a>c |
| D.在T2和n(A2)不变时达到平衡,AB3的物质的量大小为c>b>a |
X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是()
| A.元素非金属性由弱到强的顺序为Z<Y<X |
| B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 |
| C.3种元素的气态氢化物中,Z的气态氢化物最稳定 |
| D.原子半径由大到小的顺序为Z>Y>X |
反应3A(g) + B(g) ="=" 2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为:①vA="=1mol/L·min" ② vC==0.5 mol/L·min ③ vB==0.5 mol/L·min,三种情况下该反应速率大小的关系正确的是
| A.③>①>② | B.③>②>① |
| C.①>②>③ | D.②>①>③ |
少量铁粉与100ml 0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的()
①加H2O②加NaOH固体③滴入几滴浓盐酸④加CH3COONa固体
⑤加NaCl溶液⑥滴加几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)
⑧改用10ml 0.1mol/L的盐酸
| A.①⑥⑦ | B.③⑤⑧ | C.③⑦⑧ | D.③⑥⑦⑧ |
同一周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性是:
HXO4 >H2YO4 >H3ZO4,则下列判断错误的是
| A.原子半径:X > Y > Z | B.气态氢化物的稳定性:HX > H2Y > ZH3 |
| C.非金属性:X > Y > Z | D.阴离子的还原性:Z3- > Y2- > X- |
下列金属的冶炼方法不正确的是: