根据热化学方程式(在101kPa时):S(s)+O2(g)=SO2(g) ΔH=-297.23kJ·mol-1,分析下列说法中不正确的是
| A.S的燃烧热为297.23kJ·mol-1 |
| B.S(g)+O2(g)=SO2(g)放出热量大于297.23kJ |
| C.S(g)+O2(g)=SO2(g)放出热量小于297.23kJ |
| D.形成1molSO2(g)的化学键释放的总能量大于断裂1molS(s)和1molO2(g)的化学键吸收的总能量 |
把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. |
B. |
C. |
D. |
下列说法正确的是
A.原子最外层电子 数为2的元素一定处于周期表IIA族 数为2的元素一定处于周期表IIA族 |
B.主族元素X、Y能形成 型化合物,则X与Y 的原子序数之差可能为2或5 型化合物,则X与Y 的原子序数之差可能为2或5 |
| C.氯化氢的沸点比氟化氢的沸点高 |
| D.同主族元素形成的氧化物的晶体类型均相同 |
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
已知1~18号元素的离子aW3+、bX+、cY2−、dZ−都具有相同的电子层结构,下列关系正确的是
| A.离子的还原性Y2−> Z− | B.质子数c>b |
| C.氢化物的稳定性H2Y>HZ | D.原子半径X<W |
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32−、SO42−、NO3−中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是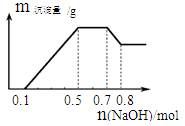
| A.溶液中的阳离子只有H+、Mg2+、Al3+ |
| B.溶液中n(NH4+)=0.2mol |
| C.溶液中一定不含CO32−,可能含有SO42−和NO3− |
| D.三种离子的物质的量之比:n(H+)∶n(Al3+)∶n(Mg2+) = 1∶1∶1 |