在密闭容器中,反应X2(g)+Y2(g)  2XY(g) ΔH <0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是
2XY(g) ΔH <0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是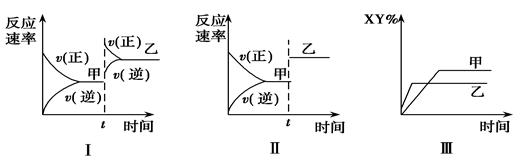
| A.图Ⅰ是增大压强的变化情况 |
| B.图Ⅱ一定是加入催化剂的变化情况 |
| C.图Ⅲ是增大压强或升高温度的变化情况 |
| D.图Ⅲ是升高温度的变化情况 |
下列叙述正确的是()
| A.离子化合物中一定含有金属元素 |
| B.金属元素不可能存在于阴离子中 |
| C.含有非极性键的化合物不一定是共价化合物 |
| D.由两种元素构成的共价化合物分子中的化学键都是极性键 |
一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应: 2X(g)+Y(g)  Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是()
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是()
| A.反应进行60s时,X、Y、Z的浓度相等 |
| B.反应进行80s时,逆反应速率大于正反应速率 |
| C.以X浓度变化表示的反应速率为0.06mol/(L•min) |
| D.反应进行80s时,Y物质的量浓度为0.03mol/L |
已知短周期元素的离子aA2+、bB+、cC2-、dD-都具有相同的电子层结构,则下列叙述正确的是()
| A.原子半径: A>B>D>C | B.原子序数: d>c>b>a |
| C.离子半径: C>D>B>A | D.单质的还原性: A>B>D>C |
下列各组金属与酸的反应,反应刚开始时,放出H2的速率最大的是()
| 金属(粉末状)/mol |
酸的浓度及体积 |
反应温度 |
|||
| A |
Mg |
0.1 |
3mol·L-1盐酸 |
10mL |
25℃ |
| B |
Fe |
0.1 |
3mol·L-1盐酸 |
10mL |
25℃ |
| C |
Mg |
0.1 |
3mol·L-1硫酸 |
10mL |
25℃ |
| D |
Mg |
0.1 |
6mol·L-1硝酸 |
10mL |
60℃ |
在一定条件下,反应N2+3H2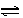 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
| A.v(H2)=0.03mol/(L·min) | B.v(N2)="0.005mol/(L·min)" |
| C.v(NH3)=0.17mol/(L·min) | D.v(NH3)=0.02mol/(L·min) |