强酸与强碱的稀溶液发生中和反应的热效应:
H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 | B.△H1<△H3<△H2 |
| C.△H1<△H2<△H3 | D.△H1>△H3>△H2 |
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时,已知数据如表所示:
| 物质 |
Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
| Ksp/25℃ |
8.0×10-16 |
2.2×10-20 |
4.0×10-38 |
| 完全沉淀时的pH范围 |
≥9.6 |
≥6.4 |
3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的溶液的说法,比较合理的( )
A.向该混合溶液中加入少量铁粉即能观察到红色固体析出
B.向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀
C.该混合溶液中c(SO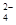 )∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
)∶[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
D.向该混合溶液中加入适量氯水,并调节pH为3~4,然后过滤,可得到纯净的CuSO4溶液
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是 ( )
| A.HCl [H2O] | B.NaOH[Na2O] | C.KI[HI] | D.CuSO4[Cu(OH)2] |
常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。判断下列说法中,正确的是( )
| A.两溶液稀释前的浓度相同 |
| B.a、b、c三点溶液的pH由大到小顺序为a>b>c |
| C.a点的KW值比b点的KW值大 |
| D.a点水电离的c(H+)大于c点水电离的c(H+) |
铅蓄电池是典型的可充电池,在现代生活中有着广泛的应用,其充电、放电按下式进行:Pb + PbO2 + 2H2SO4 2PbSO4 + 2H2O,有关该电池的说法正确的是
2PbSO4 + 2H2O,有关该电池的说法正确的是
| A.放电时,负极质量减少 |
| B.放电一段时间后,溶液的pH值减小 |
| C.充电时,阳极反应:PbSO4 +2e-=Pb+SO42- |
| D.充电时,铅蓄电池的负极与外接电源的负极相连 |
如图是某固体酸燃料电池基本结构示意图,其中以Ca(HSO4)2固体为电解质传递H+,电池总反应式为:2H2+O2====2H2O,下列有关说法不正确的是( )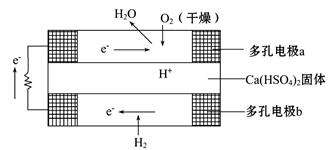
| A.H2通过多孔电极时能增大H2的接触面积,加快反应 |
| B.a极上的电极反应式为:O2+2H2O+4e-====4OH- |
| C.每转移0.1 mol电子,消耗标准状况下的H2 1.12 L |
| D.H+由b极通过固体酸电解质传递到a极 |