下列对化学平衡移动的分析中,不正确的是
① 已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
② 已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大H2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
2NH3(g),当增大H2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
③ 有气体参加的反应达平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向移动
④ 有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
| A.①④ | B.①②③ | C.②③④ | D.①③④ |
下列说法不正确的是
| A.向纯水中加入盐酸使水的电离平衡逆向移动,水的离子积不变 |
| B.NH3(g)+HCl(g)==NH4Cl(s)△H<0,低于一定温度自发,高于一定温度非自发 |
| C.铅蓄电池在放电过程中,负极质量减少,正极质量增加 |
| D.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
一种由甲醇、氧气和强碱溶液(作电解质)组成的新型手机电池,可持续使用一个月,其电池反应为: ,则有关说法正确的是
,则有关说法正确的是
| A.放电时CH3OH参与反应的电极为正极 |
| B.放电时负极的电极反应为CH3OH+8OH-→CO+6H2O+6e- |
| C.标准状况下,通入5.6 L O2并完全反应后,有0.5 mol电子转移 |
| D.放电一段时间后,通入氧气的电极附近溶液的pH降低 |
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为
A.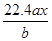 |
B.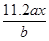 |
C.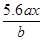 |
D.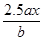 |
已知氯化银在水中存在沉淀溶解平衡:AgCl Ag+ + Cl-,25℃时氯化银的KSP=1.8×10-10。现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是
Ag+ + Cl-,25℃时氯化银的KSP=1.8×10-10。现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是
| A.100mL蒸馏水中 | B.50mL0.1mol?L-1的氯化镁溶液 |
| C.100mL0.1mol?L-1的氯化钠溶液 | D.50mL0.1mol?L-1的氯化铝溶液 |
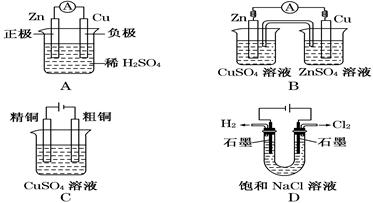
下列有关电化学的示意图中正确的是