将6.5g锌放入足量的稀硫酸中充分反应,得到80mL密度为1.25g/mL的溶液。试计算:(写出计算过程)
(1)生成标准状况下的H2多少升?
(2)所得溶液中硫酸锌的物质的量浓度。
实验室常用浓盐酸与二氧化锰反应制取少量氯气,反应的化学方程式为:
4HCl(浓) +MnO2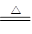 MnCl2+2H2O+Cl2↑,取足量12 mol·L-1浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为4.48L。计算(写出具体计算过程)
MnCl2+2H2O+Cl2↑,取足量12 mol·L-1浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为4.48L。计算(写出具体计算过程)
(1)被氧化的HCl的物质的量 (2) 参加反应的MnO2的质量
计算题(8分)
将1.1铁和铝的混合粉末溶于200mL、5mol/L的盐酸中,反应后盐酸的浓度变为4.6mol/L,若忽略溶液体积的变化,试计算:
(1)原混合物中铁和铝的质量各为多少?
(2)反应后产生的气体在标准状况下的体积多少?
1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将17.4gMnO2与200g 36.5%的浓盐酸(过量)完全反应,把反应后所得溶液稀释到400mL。
MnCl2+Cl2↑+2H2O。现将17.4gMnO2与200g 36.5%的浓盐酸(过量)完全反应,把反应后所得溶液稀释到400mL。
(1)请用双线桥表示该反应电子转移方向和总数 _ __。MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)计算生成Cl2的体积(折算成标准状况)为__ ____L(写计算过程,否则不得分)。
(3)计算稀释后溶液中Cl—的物质的量浓度为__ ___ mol·L—1(写计算过程,否则不得分)。
用MnO2和浓盐酸反应制Cl2,当有0.4molHCl被氧化时,生成的Cl2全部用石灰水吸收,则
(1)制氯气的反应中转移了多少个电子?
(2)生成多少升氯气?
可制得漂白粉多少克?
实验室可用浓盐酸和二氧化锰制氯气: MnO2+4HCl = MnCl2+Cl2↑+2H2O
(1)取17.4g二氧化锰与200ml37%的盐酸(密度为1.19g/ml)起反应,生成的氯气在标准状况下体积为多少升?
(2)向反应后的溶液中加入足量的AgNO3溶液,生成的沉淀质量为多少克?