在测定中和热的实验中,下列说法正确的是
| A.使用环形玻璃棒是为了加快反应速率,减小实验误差 |
| B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 |
| C.用0.5mol·L-1NaOH溶液分别与0.5 mol·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 |
| D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计 |
从下列事实所列出的相应结论正确的是( )
| 实验事实 |
结论 |
|
| ① |
铜生的锈是绿色的称为铜绿 |
铜绿是致密的氧化膜 |
| ② |
浓盐酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 |
都发生了氧化还原反应 |
| ③ |
少量CO2通入Na[Al(OH)4]溶液产生白色沉淀和Na2CO3 |
酸性:HCO3->Al(OH)3 |
| ④ |
某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味的气体,该溶液滴加CaCl2溶液,有白色沉淀现象 |
确定该溶液存在CO32- |
| ⑤ |
某无色溶液加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 |
该溶液一定有NH4+ |
A.②③⑤ B.①②③ C.③④⑤ D.全部
下列各组离子可能大量共存的是( )
| A.与铝反应放出氢气的溶液中:Na+、Cl-、S2-、SO32- |
| B.常温下Kw/c(H+)=1×10-13mol·L-1的溶液中: Ca2+、Fe2+、NO3-、NH4+ |
| C.水电离出的c(H+)=10-10 mol·L-1的溶液中Na+、K+、Cl-、HCO3- |
| D.0.5 mol·L-1AlCl3溶液中可能大量存在[Al(OH)4]-、K+、CO32- |
下列离子方程式书写正确的是()
| A.向次氯酸钙溶液通过量CO2:Ca2++2C1O-+H2O+CO2====CaCO3↓+2HClO |
| B.碘水中通入足量的SO2:I2+SO2+2H2O="===2" HI+SO42-+2H+ |
| C.FeSO4酸性溶液暴露在空气中:2Fe2++O2+4H+====2Fe3++2H2O |
| D.酸性溶液中KIO3与KI反应生成I2:IO3-+5I-+6H+=3I2+3H2O |
下列说法正确的是( )
| A.碳元素的单质只存在金刚石和石墨两种同素异形体 |
| B.Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg) |
C.粗硅 SiCl4 SiCl4 Si Si |
D.Mg(OH)2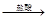 MgCl2(aq) MgCl2(aq)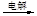 Mg Mg |
下列表示或说法正确的是( )
A.质子数为17、中子数为20的氯原子: |
| B.等物质的量的水与重水含有相同数目的中子数 |
C.氯分子的电子式: |
| D.等物质的量的铁和铝分别与足量氯气和氢氧化钠溶液完全反应时转移的电子数不同 |