下列说法中正确的是 ( )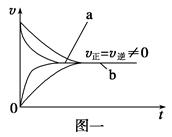

A.Na2S2O3+2HCl 2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 2NaCl+S↓+SO2↑+H2O在加热条件下化学反应速率增大的主要原因是该反应是吸热反应,加热使平衡向正反应方向移动 |
B.若在恒容容器中发生反应:N2+3H2 2NH3,达到平衡后再充入适量NH3,由于压强增大,化学平衡向正反应方向移动 2NH3,达到平衡后再充入适量NH3,由于压强增大,化学平衡向正反应方向移动 |
| C.在合成氨反应中,其他条件相同时,在有催化剂时(a)和无催化剂时(b)的速率—时间图像可用图一表示 |
D.若在恒压容器中发生反应:2SO3 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示 2SO2+O2,达到平衡后再充入适量He,其速率—时间图像可用图二表示 |
NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,生成N2和CO2,对此反应的下列叙述中正确的是()
| A.使用催化剂不能加快反应速率 |
| B.降低压强能加快反应速率 |
| C.升高温度能加快反应速率 |
| D.改变压强对化学反应速率无影响 |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
| A.SO2和SiO2 | B.CO2和H2S | C.NaCl和HCl | D.CCl4和KCl |
在下列分子结构中,所有原子的最外层电子不能满足8电子稳定结构的是:()
| A.N2 | B.PCl3 | C.HCl | D.CO2 |
当今化学界关注的热点之一的C60与足球有很相似的结构,它与石墨互为()
| A.同位素 | B.同素异形体 | C.同分异构体 | D.同一种物质 |
下列关于稀有气体的叙述中,不正确的是()
A.原子的最外电子层都有8个电子
B.其原子与同周期ⅥA、ⅦA族元素形成的阴离子具有相同的核外电子排布
C.通常条件下,化学性质非常不活泼
D.原子核外电子的排布都达到了稳定结构