下列说法中正确的是( )
| A.PCl3、NH3、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 |
| B.1mol SiO2中含有2mol共价键 |
| C.NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
| D.原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度 |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知有关原溶液中离子的说法不正确是()
| A.SO42-、NH4+一定存在 |
| B.CO32-、Al3+、K+一定不存在 |
| C.Cl-一定存在,且c(Cl-)≥0.4mol/L |
| D.至少存在4种离子 |
下图为海水综合利用的工业流程图,判断下列说法正确的是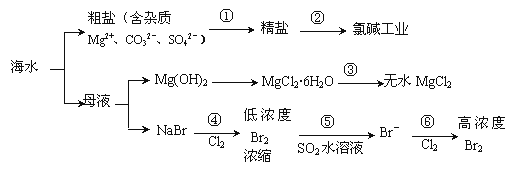
| A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 |
| B.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.在过程④、⑥反应中每氧化0.2 mol Br-需消耗0.1mol Cl2 |
| D.除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
向1 L仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量的变化如图所示,下列说法中正确的是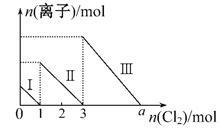
| A.线段Ⅲ表示Fe2+的变化情况 | B.线段Ⅰ表示Br-的变化情况 |
| C.原溶液中c(FeBr2)="4" mol·L-1 | D.a数值等于6 |
向盛有100 mL HCl溶液的烧杯中加入一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,充分反应后过滤,向滤液中加入5 mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如下图所示。则原HCl物质的量浓度是 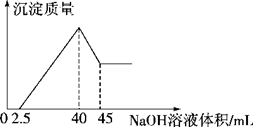
| A.1mol/L | B.2mol/L | C.3mol/L | D.4mol/L |
下列装置用于收集气体并验证其某些化学性质,下列相关的选项正确的是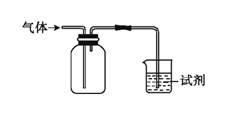
| 选项 |
气体 |
试剂 |
现象 |
结论 |
| A |
NH3 |
酚酞试液 |
溶液变红色 |
NH3的水溶液显碱性 |
| B |
SO2 |
酸性KMnO4溶液 |
溶液褪色 |
SO2具有漂白性 |
| C[] |
HCl |
硅酸钠溶液 |
生成白色沉淀 |
Cl的非金属性比Si强 |
| D |
X |
KI淀粉溶液 |
溶液变蓝 |
X可能是Cl2 |