下列各项中,理由、结论及因果关系均正确的是( )
| 选项 |
理由 |
结论 |
| A |
键能:N≡N>Cl-Cl |
单质沸点:N2>Cl2 |
| B |
元素的非金属性:N>P |
稳定性: NH3>PH3 |
| C |
分子中可电离的H+个数:H2SO4>CH3COOH |
酸性:H2SO4>CH3COOH |
| D |
氧化性:Fe3+>Cu2+ |
还原性:Fe2+>Cu |
在相同条件下,将相同物质的量的Na、Mg、Al分别加入盛有同浓度、同体积稀盐酸的甲、乙、丙三个烧杯中充分反应,生成气体的体积关系不可能是( )
| A.甲(Na)>乙(Mg)>丙(Al) | B.甲(Na)>乙(Mg)=丙(Al) |
| C.甲(Na)<乙(Mg)<丙(Al) | D.甲(Na)=乙(Mg)=丙(Al) |
下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
| 物质 编号 |
物质转化关系 |
a |
b |
c |
d |
| ① |
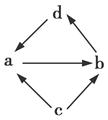 |
FeCl2 |
FeCl3 |
Fe |
CuCl2 |
| ② |
NO |
NO2 |
N2 |
HNO3 |
|
| ③ |
Na2O |
Na2O2 |
Na |
NaOH |
|
| ④ |
Al2O3 |
NaAlO2 |
Al |
Al(OH)3 |
A.①④B.②③C.①③D.②④
已知下列转化关系中,M、N均为单质,则M可能是( )
M+N Q
Q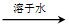 Q溶液
Q溶液 M+N
M+N
| A.H2 | B.Na | C.Fe | D.Al |
下列说法中正确的是( )
| A.常温下,浓硫酸、浓硝酸均能将金属铜氧化,且均能使铁钝化 |
| B.乙烯常用作植物催熟剂,乙酸常用作调味剂,乙醇常用于杀菌消毒 |
| C.玛瑙、水晶、钻石的主要成分均为SiO2 |
| D.蛋白质、纤维素、蔗糖、天然橡胶都是高分子化合物 |
氧元素有三种核素16O、17O、18O,它们在自然界中所占的原子个数百分比分别为a%、b%、c%,则下列说法正确的是( )
| A.一个16O原子的质量为16 g |
| B.17O的相对原子质量约为17 |
C.氧元素的相对原子质量为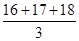 |
| D.氧元素的相对原子质量为(16a%+17b%+18c%) |