X、Y、Z、R为前四周期元素且原子序数依次增大。X的单质与氢气可以化合生成气体G,可使湿润的红色石蕊试纸变蓝;Y单质是一种黄色固体;R是一种应用最广的金属,它的一种含氧酸根化学式为RO42-,且具有强氧化性。Y、Z分别与钠元素可以形成化合物Q和J,J的水溶液与AgNO3溶液反应可生成不溶于稀硝酸的白色沉淀L。则下列说法不正确的是( )
| A.R在元素周期表中位置为第四周期VIII族 |
| B.Na2RO4水溶液可以用于杀菌消毒和净水 |
| C.1molY或Z与足量的R反应均转移2mol电子 |
| D.G为极性分子,中心原子采取sp2杂化 |
化合物Bilirubin在一定波长的光照射下发生分解反应,反应物浓度随反应时间变化如图所示,计算反应4~8 min间的平均反应速率和推测反应16 min时反应物的浓度,结果应是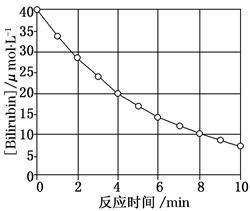
| A.2.5 μmol·L-1·min-1和2.0 μmol·L-1 |
| B.2.5 μmol·L-1·min-1和2.5 μmol·L-1 |
| C.3.0 μmol·L-1·min-1和3.0 μmol·L-1 |
| D.5.0 μmol·L-1·min-1和3.0 μmol·L-1 |
对可逆反应2A(s)+3B(g)  C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v (正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
| A.①② | B.④ | C.③ | D.④⑤ |
依据下表判断CH3CH3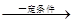 CH2=CH2+H2的反应热为
CH2=CH2+H2的反应热为
| 化学键 |
C-H |
C=C |
C-C |
H-H |
| 键能(kJ·mol-1) |
414.4 |
615.3 |
347.4 |
435.3 |
A.125.6kJ·mol-1B.-125.6kJ·mol-1
C.46.1kJ·mol-1D.-46.1kJ·mol-1
工业制氢气的一个重要反应是: 已知在25℃时:
已知在25℃时: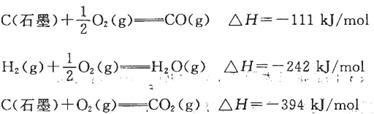
则2 5℃时1 mol CO与水蒸气作用转化为氢气和二氧化碳反应△H为
| A.+41.kJ/mol | B.-41kJ/mol | C.283kJ/mol | D.-131kJ/mol |
密闭容器中有如下反应:mA(g)+nB(g) pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍。下列说法中正确的是
pC(g)达到平衡后,保持温度不变,将容器体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.8倍。下列说法中正确的是
| A.m+n>p | B.A的转化率降低 |
| C.平衡向正反应方向移动 | D.C的质量分数增加 |