周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子排布式为 。
(2)a和上述元素中的一种元素形成的共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;上述元素形成的分子中既含有极性共价键、又含有非极性共价键的化合物是 (填化学式)。
(3)这些元素形成的含氧酸中,酸根中的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥形结构的酸是 。(均填化学式)
(4)e和c形成的一种离子化合物的晶体的晶胞结构(图1),则e的化合价为 。
(5)这5种元素形成的一种阴阳离子数比为1:1的离子化合物中,阴离子呈四面体结构;阳离子呈狭长的八面体结构(图2)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 。
(6)根据e晶胞结构(图3),e晶胞中每个e原子周围距离最近的e原子数目为 。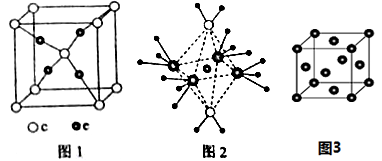
化学上常用燃烧法确定有机物的组成.下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品.根据产物的质量确定有机物的组成.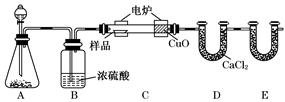
回答下列问题:
(1)A装置中分液漏斗盛放的物质是______________,写出有关反应的化学方程式
______________________________________________________________.
(2)C装置(燃烧管)中CuO的作用是______________________________________
____________________________.
(3)写出E装置中所盛放试剂的名称__________,它的作用是______________.
(4)若将B装置去掉会对实验造成什么影响? __________________________.
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种).经充分燃烧后,
E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为______________.
(6)要确定该有机物的化学式,还需要测定________________________.
质子核磁共振谱(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一结构中的等性氢原子在PMR谱中都给出了相应的峰(信号),谱中峰的强度与结构中的H原子数成正比.例如,乙醛的结构式为CH3CHO,其PMR谱中有两个信号,其强度之比为3∶1.
分子式为C3H6O2的有机物,如果在PMR谱上观察到的氢原子给出的峰有两种情况.第一种情况峰给出的强度比为3∶3,请写出其对应化合物的结构简式_________________.
第二种情况峰的强度比为3∶2∶1,请写出该化合物的可能的结构简式___________.
某有机物由C、H、O三种元素组成,它的红外吸收光谱表明有羟基中O—H键和烃基中C—H键的红外吸收峰,且烃基与羟基上氢原子个数之比为2∶1,其相对分子质量为62,试写出该有机物的结构简式(提示:同一碳原子上不能连有两个—OH).
________________________________________________________________________
在最新的家用汽车的调查中发现,新车中气体的质量不符合标准.汽车污染主要来源于汽车配件及材料.它们都会产生大量的有毒有机物气体.其中一种有毒气体的质谱图如下: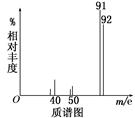
则由图可知该分子的相对分子质量是________,若该分子的核磁共振氢谱中有4个吸收峰则有机物的名称为________,其苯环上的一氯代物有________种。
酒精在人体肝脏内可转化为多种有害物质,有机物A是其中的一种,对A的结构进行如下分析:
①通过样品的质谱分析测得A的相对分子质量为60;
②核磁共振氢原子光谱能对有机物分子中同性氢原子给出相同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:乙醇(CH3CH2OH)有三种氢原子(图1).经测定,有机物A的核磁共振氢谱示意图如图2: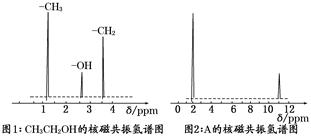
③对A的水溶液进行测定发现该溶液pH<7.
根据以上分析,写出A的结构简式________.